真核生物细胞中,大部分基因组DNA被组蛋白八聚体缠绕形成核小体,并进一步折叠成染色质,维持基因调控网络的稳定,但同时也对转录因子形成了天然屏障。然而,一类被称为“先锋转录因子”(pioneer transcription factor)的特殊因子能够突破这一障碍。它们能直接结合核小体,并可以靶向沉默状态的染色质,随后招募其他表观因子、染色质重塑蛋白等,改变染色质可及性进而调控基因表达网络,建立细胞的新命运【1, 2】
RFX5是目前唯一被报道具有此类“先锋”功能的RFX家族成员,主要参与第二类主要组织相容性复合体(class II major histocompatibility complex, MHC II)的表达调控,其功能缺失会导致裸淋巴细胞综合征(Bare lymphocyte syndrome, BLS)等疾病【3】。前期研究表明,RFX5在体外可以结合核小体,并在体内能够介导核小体重塑,但其具体的分子机制尚未明确【4】。
2025年7月31日,同济大学医学院附属上海市第四人民医院许可教授、尹贻蒙教授、上海有机化学研究所张一小研究员和清华大学生命科学学院/北京生物结构前沿研究中心陈春来副教授联合在Nucleic Acids Research上发表了文章Structural basis of nucleosome binding and destabilization by the extended DNA binding domain of RFX5,首次从结构层面揭示了RFX5如何结合核小体并调控其状态。

研究团队首先通过NCAP-SELEX技术筛选获得了RFX5高亲和力的核小体DNA序列,并在此基础上利用冷冻电镜技术解析了RFX5延长DNA结合域(eDBD)与核小体复合物的结构(分辨率3.3 Å)。结构显示,RFX5 eDBD结合在核小体SHL +2位置,通过大量氢键和DNA结合。同时,RFX5的 Glu102和组蛋白H2A的 Arg78和H2B的 Ser57之间形成氢键。这种转录因子与组蛋白的相互作用,在多个先锋转录因子中被证明对其结合核小体至关重要,提示Glu102可能是RFX5实现核小体结合的关键位点。此外,RFX5的结合引发了结合位点DNA的局部扭曲,并诱导SHL -4以外的DNA从核小体上解离,显著提高了DNA的可及性。为验证这一结构变化,研究人员开展了MNase酶切实验,发现RFX5-核小体复合物的消化产物显著短于单独核小体,提示复合体中的DNA更容易被酶切。进一步的FRET实验也观察到RFX5结合后FRET信号显著降低,反映DNA末端从核小体上解离。这些结果从结构与功能两个层面共同验证了RFX5通过结合核小体,提升核小体DNA可及性的能力。
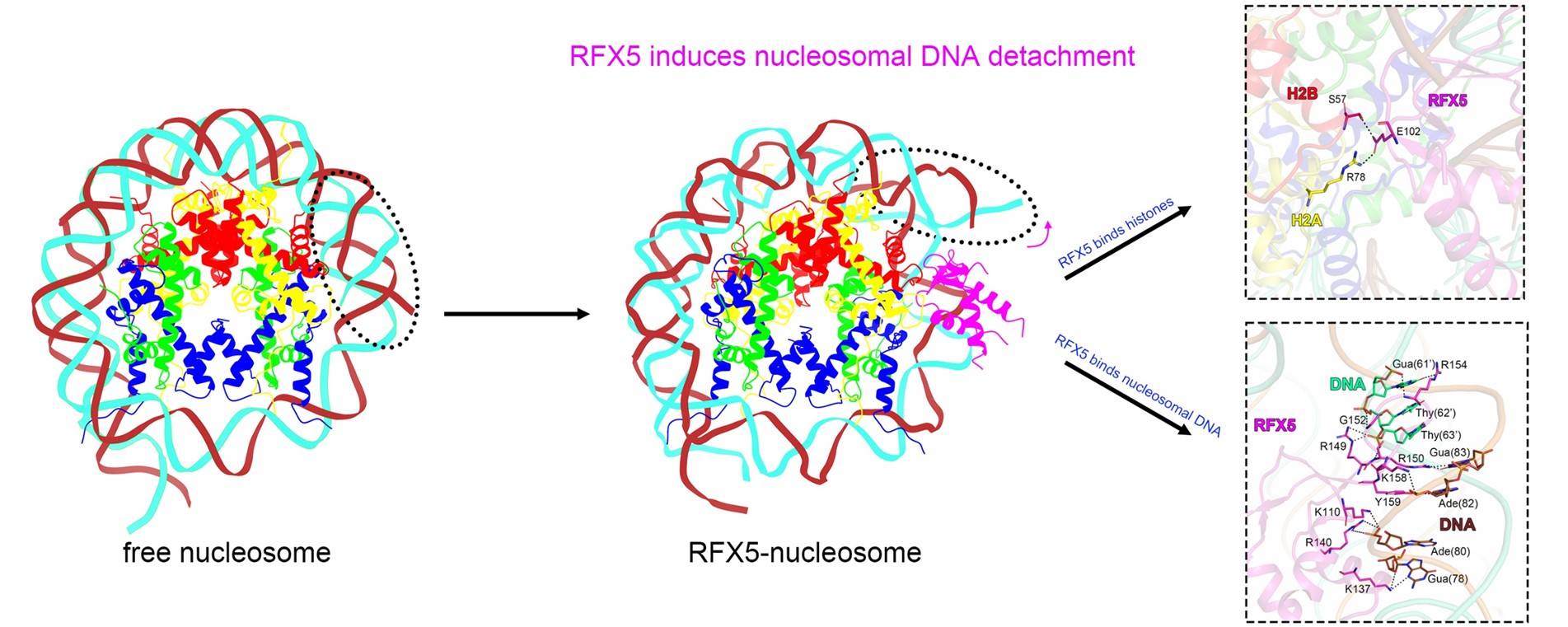
为探究RFX5在细胞内和核小体的结合特征,研究团队分析了HEK293和H9细胞的MNase-ChIP数据,结果显示RFX5可以结合于核小体的多个位置,并且在SHL +2位置处有明显的富集信号。进一步分析发现,当RFX5结合在核小体SHL +2位置时,核小体SHL –4 之外的DNA 区域显著富集了其他转录因子的结合位点(motif),提示RFX5介导的核小体DNA可及性增加,为后续其他转录因子结合创造了有利条件。
总之,该研究首次提供了RFX5结合核小体并打开DNA的结构证据,为先锋转录因子调控核小体状态的分子机制提供了新的见解。
同济大学医学院附属上海市第四人民医院许可教授、尹贻蒙教授、上海有机化学研究所张一小研究员和清华大学生命科学学院/北京生物结构前沿研究中心陈春来副教授为该论文的共同通讯作者。同济大学医学院薛皖强、田英、上海有机化学研究所韩瑶瑶和清华大学生命科学学院王君正为该研究的共同第一作者。









