革兰氏阴性菌的多重耐药性已成为全球重大公共卫生威胁,而AcrAB-TolC等三联体多药外排泵是介导耐药性的核心机制之一。作为大肠杆菌中研究最透彻的外排系统,AcrAB-TolC系统横跨细菌内外膜,通过内膜转运蛋白AcrB、周质适配蛋白AcrA与外膜通道蛋白TolC的协同作用,能够外排包括临床常用抗生素在内的多种毒性底物,同时还可通过支持细菌在宿主环境中的存活参与致病过程。尽管人们对AcrAB-TolC外排系统持续关注、不断研究,但仍存在诸多知识缺口。
2025年12月18日,清华大学生命科学学院/北京生物结构前沿研究中心王佳伟课题组在eLife发表题为“AcrAB-TolC外排系统泵组装和药物转运的结构机制”(Structural mechanisms of pump assembly and drug transport in the AcrAB-TolC efflux system)的研究论文。该研究利用冷冻电镜技术,从大肠杆菌天然表达的TolC-AcrABZ复合物中解析和鉴定出了一种全新的外膜脂蛋白组分YbjP。通过分析完整的TolC-YbjP-AcrABZ外排泵复合物结构,研究进一步揭示了YbjP对TolC锚定于大肠杆菌外膜的关键辅助作用,并首次在完整外排泵复合物中同时展示出AcrB三聚体处于三种不同构象状态的结构。
研究人员从大肠杆菌中纯化出自然表达的TolC相关蛋白复合物,包括游离的TolC蛋白三聚体以及TolC-AcrABZ复合物。对游离TolC三聚体进行冷冻电镜三维重构,得到分辨率为3.56 Å的密度图后,研究者意外发现该复合物的周质空间侧存在不属于TolC的额外密度。基于该密度,研究者从头搭建了相应的蛋白主链模型,并使用CryoNet对AlphaFold数据库进行筛选,最终鉴定出此区域对应一种功能未知的大肠杆菌脂锚定蛋白YbjP,它与TolC形成3:3结合的稳定复合物(图1)。许多革兰氏阴性菌的TolC同源物(如假单胞菌OprM、大肠杆菌CusC等)自身即可与脂质共价锚定,但在TolC中没有类似的现象被报道。本研究揭示了YbjP是一种新型外膜伴侣蛋白,很可能有助于TolC锚定于外膜并调控TolC依赖性通路。
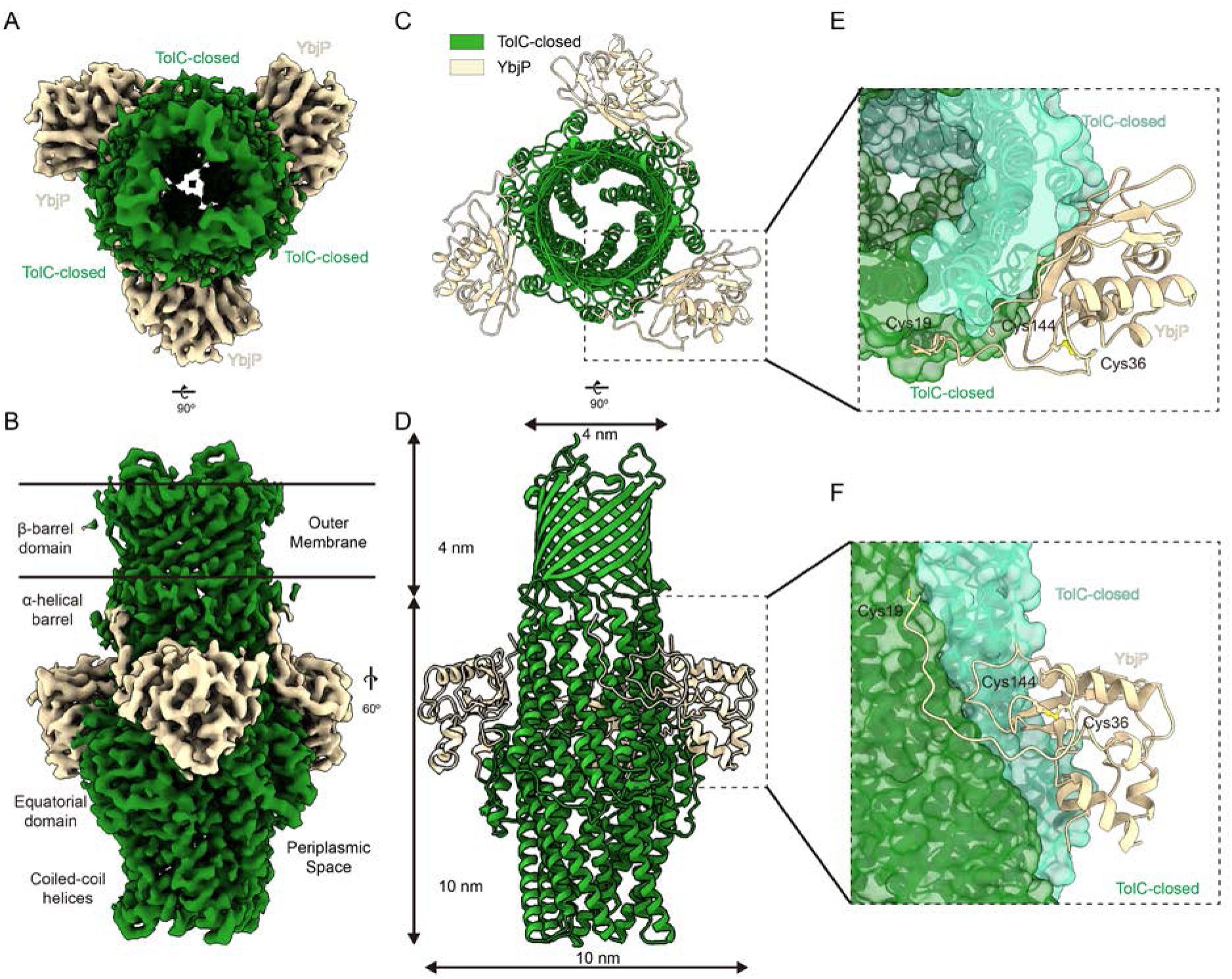
图1. TolC–YbjP复合物的结构
对天然TolC-AcrABZ复合物的三维重构得到了一个分辨率为3.39 Å的密度图,同样在TolC的周质空间侧鉴定出清晰的YbjP密度。这表明YbjP在AcrAB-TolC系统组装过程中被保留,实际上形成了一种此前未被揭示的TolC-YbjP-AcrABZ外排泵复合物(图2)。TolC与YbjP相连,覆盖外膜末端,并与周质空间中由AcrA衔接蛋白组成的六聚体环对接,该六聚体环又包围着嵌入内膜的AcrBZ三聚体。互作分析揭示了该泵复杂的组装机制:AcrZ增强AcrB的跨膜结构域,AcrB的漏斗结构域和转运结构域锚定AcrA,而AcrA的α螺旋发夹结构与TolC结合。对比TolC-YbjP和TolC-YbjP-AcrABZ复合物,能够发现TolC在结合AcrA后显著扩张,其卷曲螺旋发生了剧烈的旋转构象重排。YbjP在两种构象状态下均与TolC保持稳定的结合。这种持续的相互作用表明YbjP发挥着结构支架的作用,将TolC锚定在外膜上,适应激活过程中的构象变化,并在功能上弥补TolC自身缺乏脂化修饰的缺陷。
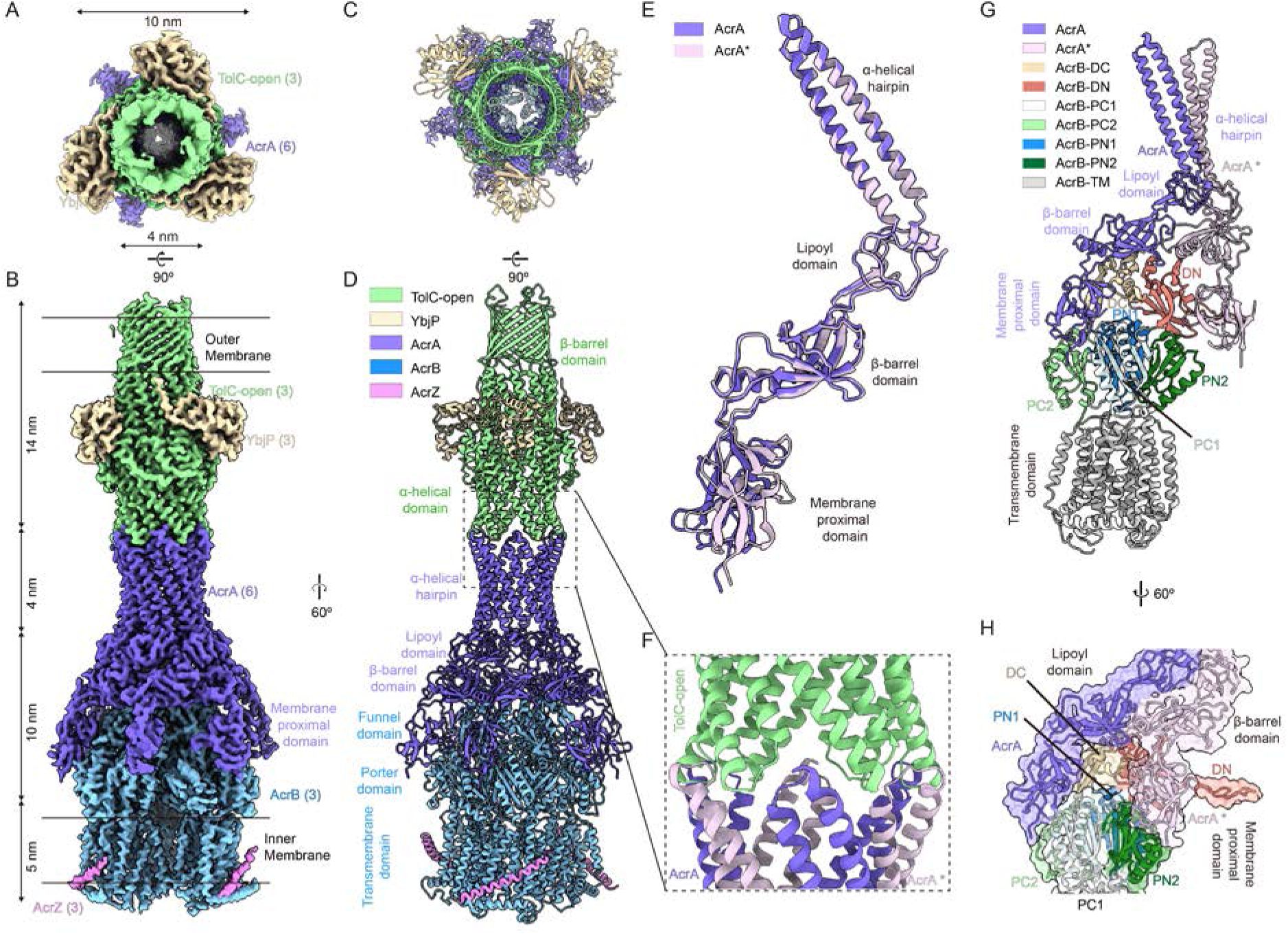
图2. 完全组装的TolC–YbjP–AcrABZ外排泵的结构
AcrAB-TolC外排系统主动逆浓度梯度运输底物,将其从低浓度区域转移到高浓度区域。这一能量上不利的过程由质子动力势 (PMF) 驱动,AcrB三聚体利用质子的电化学势来驱动底物转运。经典模型认为AcrB三聚体采用一种不对称旋转机制驱动底物转运,其中每个AcrB原聚体依次经历三种构象状态:L(松散)、T(紧密)和 O(开放)。这种协同构象旋转类似于ATP合成过程中F1F0ATP合酶的循环。本研究获取了内源性TolC–YbjP–AcrABZ 外排泵的高分辨率结构,并首次展示了同时处于三种不同构象状态的AcrB三聚体结构(图3),从而提供了关键的机制信息。转运结构域由四个亚结构域(PN1、PN2、PC1和PC2)组成,从周质侧观察时呈顺时针方向排列,其中 PN1最靠近三聚体的中心轴。虽然跨膜结构域在L和T状态下基本保守,但T→O转变需要TM2、TM4、TM5和TM6的协同旋转,从而破坏这些相互作用。底物进入发生在L状态下的PC1和PC2之间,随后在L→T转变过程中PC2向PC1移动8 Å,从而促进药物从入口口袋转移到高亲和力深结合口袋。值得注意的是,PC1在整个循环过程中始终与AcrA保持接触。质子通过跨膜结构域的转运会引发三个协同事件:(1)PC2和PC1之间进一步压缩5 Å;(2)PN2胞质面向内旋转;以及(3)PN1周质面向外打开。这些事件共同将底物排出到中央通道中。
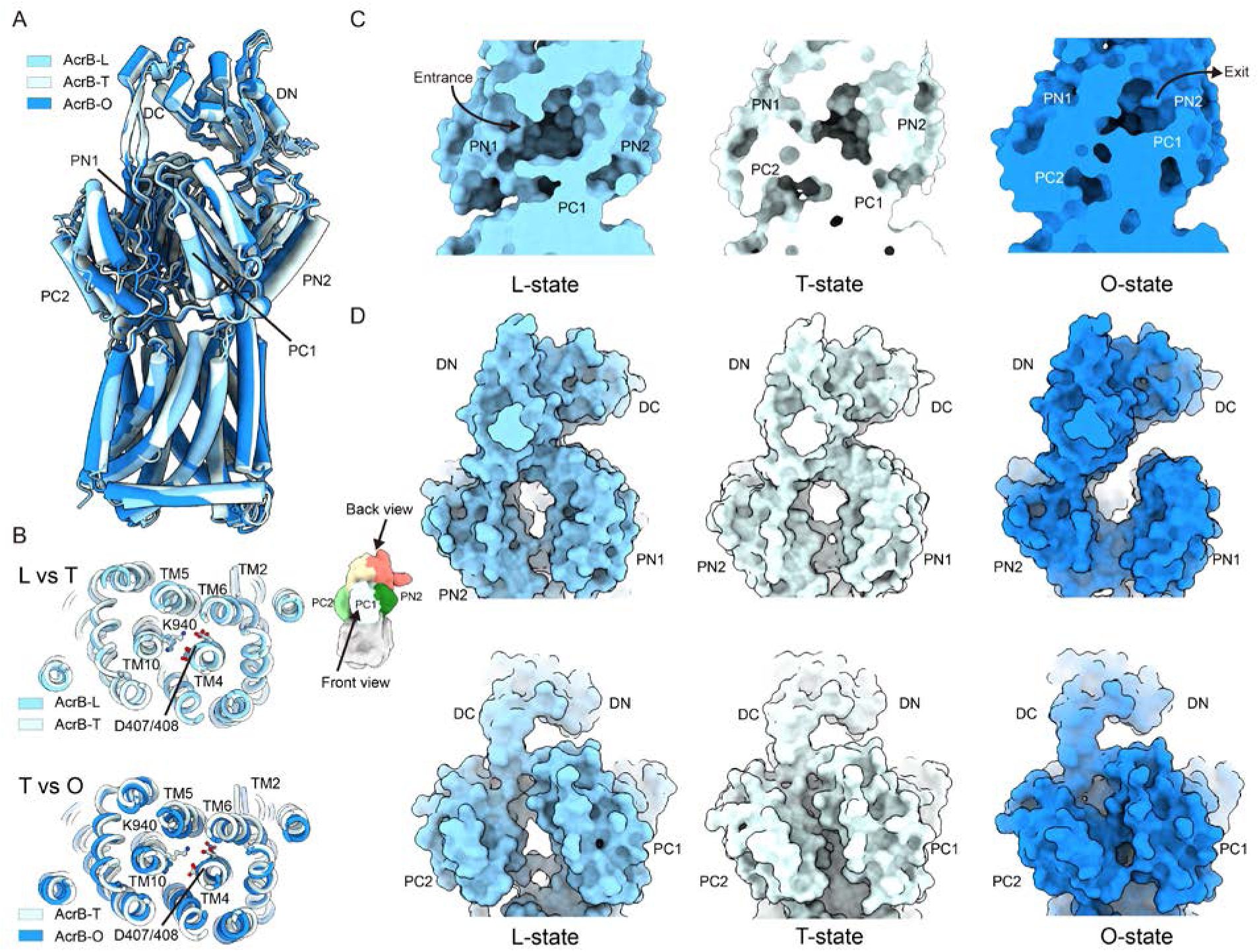
图3. 功能性三聚体中 AcrB 单体的构象循环
总之,这项工作首次鉴定出AcrAB-TolC系统的天然组分YbjP,并首次在完全组装的天然TolC-YbjP-AcrABZ复合物中捕捉到了AcrB三聚体的所有三种构象状态(L、T、O)。这些发现丰富和完善了人们对AcrAB-TolC转运系统的理解,并展示了高分辨率冷冻电镜结合整合建模技术能够揭示此前未被表征的蛋白质因子。
清华大学生命科学学院/北京生物结构前沿研究中心王佳伟副教授和生命学院20级博士毕业生葛霄飞为本文共同通讯作者;葛霄飞为本文第一作者;清华大学生命学院22级博士生顾志炜也参与此研究。电镜数据采集在国家蛋白质科学研究(北京)设施的冷冻电镜平台完成。本研究得到了国家自然科学基金的经费支持。









