SLC4转运蛋白家族在维持细胞内外的离子平衡与酸碱稳态中扮演着核心角色。BTR1(Bicarbonate Transporter Related protein-1)是该家族的重要成员,早期研究提示其可能转运硼酸盐,后续功能研究将其定义为一种NH₃/H⁺共转运体。它在调节细胞内外酸碱平衡、氨代谢与排泄、以及维持肾脏、神经系统和视觉功能等方面至关重要,其功能异常已被证实与角膜营养不良、听力损失及神经系统障碍等多种疾病密切相关。尽管已有研究揭示了BTR1的部分功能及其受PIP2调控的构象变化机制,但其底物选择性与动态转运过程仍不明确。
2025年12月6日,清华大学生命科学学院/北京生物结构前沿研究中心杨茂君教授研究团队在《Protein & Cell》杂志上在线发表了题为“Cryo-EM structures and transport mechanism of human multifunctional transporter BTR1”的研究论文。该研究系统解析了人源BTR1蛋白在多种生理相关条件(不同pH及离子环境)下的高分辨率三维结构,并深入阐明了其独特的双功能转运模式与构象调控机制。

研究团队成功解析了BTR1在天然状态下的结构,发现其呈现出典型的“内向开放”(inward-open)构象。重要的是,研究捕捉到在酸性、碱性或存在NH₄Cl条件下,BTR1能够转变为“外向开放”(outward-open)构象,直接揭示了该蛋白受环境调控的构象转变特性。结构比较分析显示,BTR1具有与其他已知SLC4成员有着显著不同的结构特征。电生理实验证实,BTR1不仅能够转运Na⁺、H⁺/OH⁻,更是一个高效的NH₃转运蛋白,且在Na⁺存在时,其NH₃转运能力显著增强。通过结构分析与定点突变,研究鉴定出T434、T435、H719等一系列关键氨基酸残基,这些残基构成底物结合与识别口袋,并直接参与调控蛋白的构象变化与转运活性。突变这些位点可显著改变BTR1的电流响应并削弱其转运功能。
综合所有结构与功能数据,本研究提出了BTR1工作的全新模型:BTR1具备双重功能模式。在缺乏NH₃的环境中,它主要作为Na⁺依赖的H⁺/OH⁻转运体,参与酸碱平衡调节;而当环境中存在NH₃时,它则转变为高效的、Na⁺协同增强的NH₃转运蛋白,介导氨的快速跨膜转运。该研究极大地深化了对SLC4家族蛋白功能多样性与调控复杂性的理解。研究成果为深入探讨BTR1功能异常相关疾病(如角膜营养不良、神经障碍等)的病理机制提供了关键的结构基础,同时也为未来开发针对此类转运蛋白的靶向治疗药物奠定了坚实的理论依据。
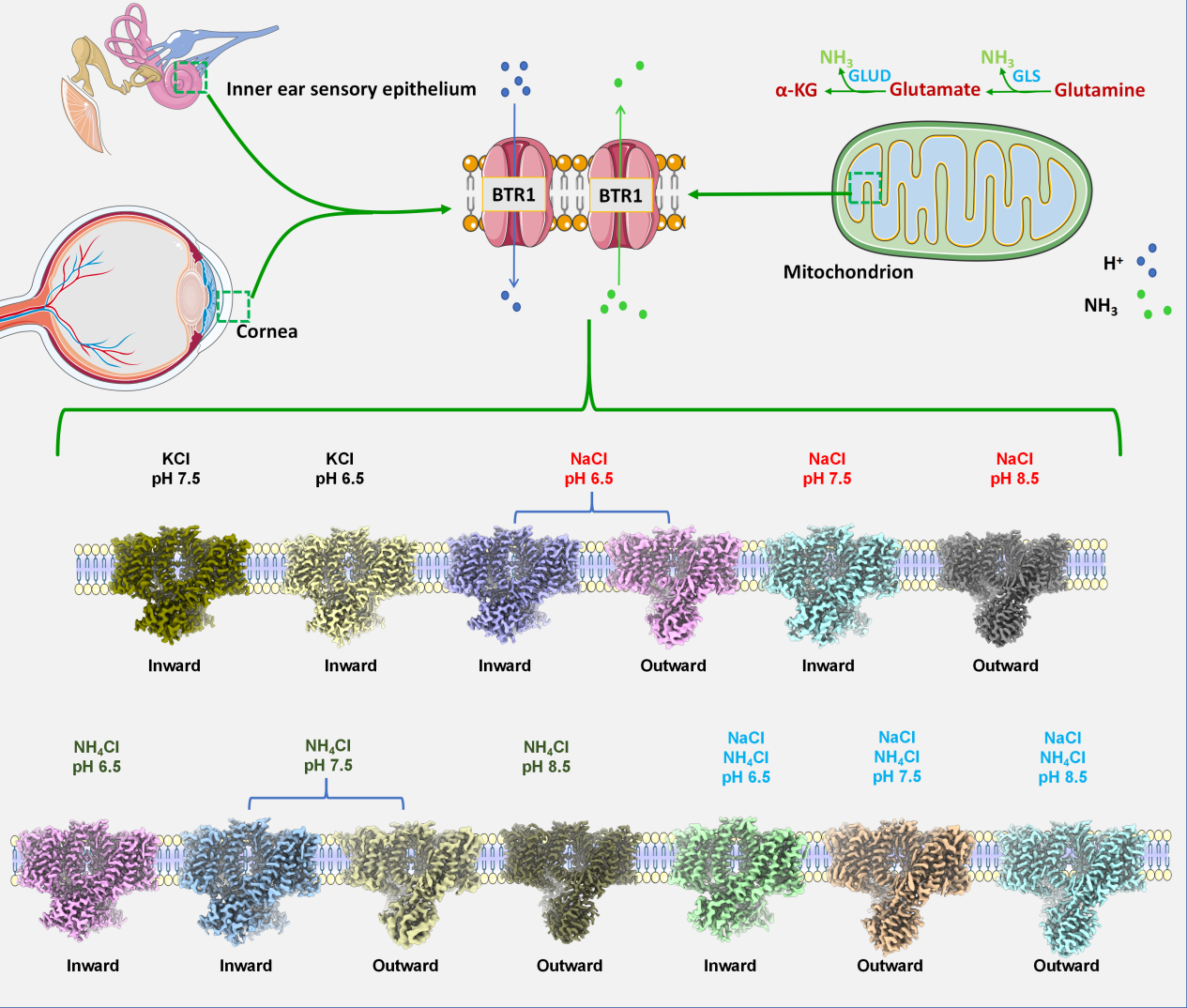
图1 BTR1蛋白在不同环境条件下的构象变化
杨茂君教授研究组长期致力于重要膜蛋白的结构与功能研究。北京生命科技研究院助理研究员刘畅、清博汇能医药科技有限公司陈旭东博士、中国科学院上海药物研究所常柳柳博士生为本论文的共同第一作者。清华大学生命科学学院/北京生物结构前沿研究中心杨茂君教授,中国科学院上海药物研究所李扬教授,北京生命科技研究院谢剑平研究员、毛健高级工程师及张森森博士为本论文的共同通讯作者。本研究获得了国家重点研发计划、国家自然科学基金、北京生命科技研究院科研项目以及北京生物结构前沿研究中心的大力资助。









