2021年8月6日,《科学·免疫》杂志在线发表了北京生物结构前沿研究中心祁海教授课题组题为《Virtual memory T-cells orchestrate extra-lymphoid responses conducive to resident memory》(《虚拟记忆T细胞启动可形成组织驻留性记忆的淋巴器官外免疫应答》)的研究论文。(原文:https://immunology.sciencemag.org/content/6/62/eabg9433)。该研究发现机体识别自身抗原产生的异质性虚拟记忆T细胞在区域组织免疫应答中介导先天性及获得性免疫反应新机制,为设计基于CD8 T细胞的对抗肺部感染的疫苗提供新思路。
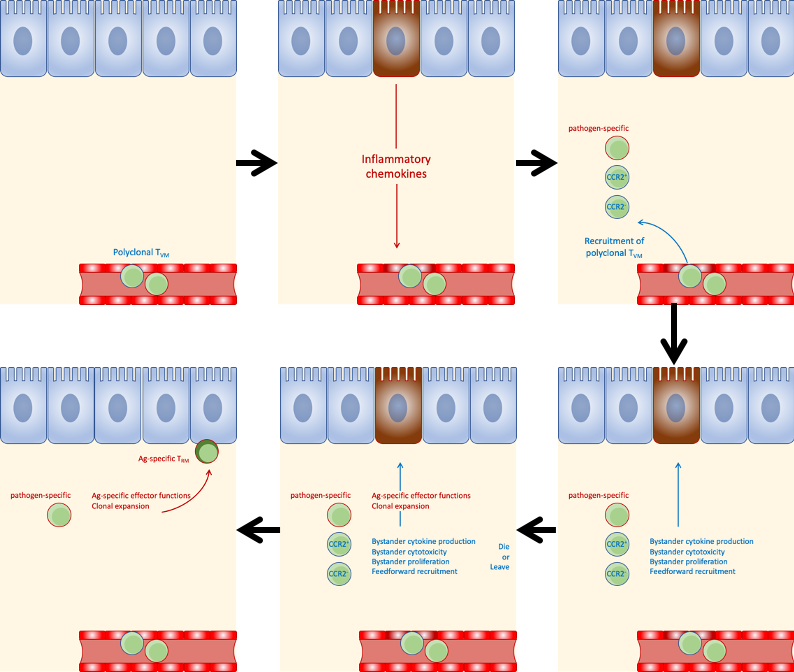
TVM 细胞参与非淋巴组织内初次免疫应答并产生组织驻留型记忆细胞的模式图
使用流感病毒对无特殊病原体(SPF)的小鼠进行肺部感染,祁海组研究者们惊奇地发现早于感染后18小时有大量的TVM细胞入侵组织,由于细胞进行组织入侵依赖于趋化因子受体,通过体外筛选,研究者们发现TVM细胞存在表达趋化因子受体CCR2的亚群。并且在早期肺部入侵过程中CCR2阳性TVM细胞具有显著优势。进一步通过基因敲除小鼠、骨髓重建嵌合小鼠等工具,对这些组织入侵的TVM细胞功能进行探索,发现这些细胞在病毒感染早期具有非常重要的控制组织病毒载量的功能,这一功能主要是通过TVM细胞抗原非特异的先天性免疫特征所实现。传统意义上T细胞的活化需要经历一个复杂的途径:组织接受病原感染后树突状细胞捕获抗原迁移至局部引流淋巴结中,在淋巴结中活化TN细胞,进一步分化成为效应T细胞后迁移回区域组织发挥效应功能。但由于感染早期大量TVM细胞入侵组织,研究者们猜测,这一多克隆的细胞群体很可能存在克隆型可以直接识别组织中的抗原,在组织中进行局部增殖而发育成为抗原特异的效应细胞。祁海组研究者们通过抗体阻断结合单细胞测序方法证实了这一假说,发现早期入侵组织的多克隆TVM细胞可以以次级淋巴器官非依赖的方式进行抗原特异增殖,揭示了一条T细胞活化的新途径。最后,研究者们大胆猜测,早期进入组织中的TVM细胞在组织中局部增殖最终可能会发育为TRM细胞。通过多克隆及单克隆细胞过继转移实验,祁海组研究者们发现TVM细胞不仅可以,且具有更强的产生TRM细胞的能力,该发现揭示了组织驻留性记忆细胞生成的新路径。
据此,祁海组研究者们发现了免疫记忆细胞新型异质性功能群体,揭示了机体利用自身免疫性产生的TVM细胞对抗外来病原的新机制,TVM细胞可以作为先天性与后天性免疫的桥梁,在免疫极早期进行免疫巡视,效应期进行病原体特异性清除,并以强于幼稚细胞的优势发育为TRM细胞对抗二次免疫反应,为设计细胞疫苗提供新思路。
祁海教授课题组专注于研究体液免疫应答调节机制,免疫应答两性差异的分子基础,组织驻留性CD8记忆T细胞发育机制及疫苗应用,中枢系统神经回路对免疫应答的调控机制等,就上述领域的前沿科学问题在Nature, Science, Immunity, Nature Immunology等期刊发表多篇原著论文。清华大学医学院侯诗玥博士与医学院2015级博士研究生邵天歌是本文的共同第一作者,已毕业的毛天杨、史静雯博士、2018级博士生孙佳慧做出了重要贡献。该课题得到清华大学结构生物学高精尖创新中心谭旭教授及梅淼博士的重要支持。该课题的资助来自于科技部国家重点研发项目计划(项目2018YFE0200300)、国家自然科学基金(项目81621002,31800738)、清华-北大生命科学联合中心、北京市科学技术委员会、北京生物结构前沿研究中心、比尔·梅琳达盖茨基金-霍华德休斯医学研究所及博士后创新人才支持计划(BX201700135)。









