白细胞介素-12(IL-12)家族的细胞因子由α亚基(p35、p19和p28)和β亚基(p40和EBI3)构成,具有形成异源二聚体、亚基和信号组分共享的特性。目前在人体内确定的家族成员包括IL-12(由p35和p40亚基结合形成)、IL-23(由p19和p40亚基结合形成)、IL-27(由p28和EBI3亚基结合形成)以及IL-35(由p35和EBI3亚基结合形成)(图1)。这些细胞因子主要由不同类型的抗原呈递细胞、调节性T细胞和调节性B细胞产生,作用于T细胞、自然杀伤(NK)细胞以及B细胞等。它们在调控免疫应答和保持免疫系统的稳定中发挥着至关重要的作用,对自身免疫性疾病的发生及癌症的发展有着显著影响,是重要的治疗靶点。因此深入了解该家族细胞因子如何组装受体介导下游信号通路的分子机制,对于开发治疗策略具有重要意义。
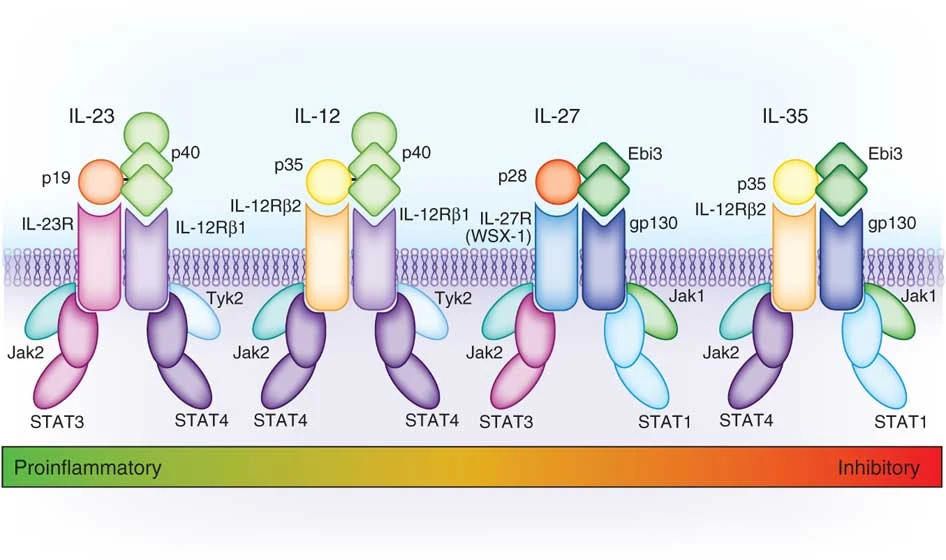
图1. IL-12家族细胞因子结合受体及其下游信号组分的结构模型
2024年8月6日,清华大学生命科学学院/北京生物结构前沿研究中心王新泉教授课题组在《结构》(Structure)杂志在线发表研究论文,题目为“人源IL-12信号复合物的结构与组装”(Structure and assembly of the human IL-12 signaling complex)。该研究成果增强了对IL-12信号起始的理解,同时也为IL-12的改造和治疗应用开辟了新的机会。
论文作者首先解析了人源IL-12结合受体IL-12Rβ1和IL-12Rβ2的冷冻电镜结构,总体分辨率达到3.75埃(图2A)。这是一个由四个IL-12/IL-12Rβ1/IL-12Rβ2信号转导基本单元组装成的十二聚体结构。每个IL-12/IL-12Rβ1/IL-12Rβ2三元复合物包含3个相互作用界面(site1-3)。Site 1是IL-12 p35和p40亚基之间的相互作用界面,p35亚基在site 3与IL-12Rβ2氨基端的Ig-like结构域相互作用,而p40亚基在site 2与IL-12Rβ1氨基端的FnIII结构域结合(图2B)。此结果表明IL-12与受体的结合和组装方式和IL-23相似,但和同一家族的IL-27有显著差异。通过结构比较,论文作者还发现IL-12中 p35和p40亚基的结合界面在不同状态下(apo、受体结合和抗体结合)有明显的构象差异,体现了IL-12家族细胞因子在亚基组装层面的结构柔性。
通过定点突变和亲和力检测,论文作者发现将p35亚基上的Y62和K192突变成丙氨酸后,极大破坏了IL-12和特异性受体IL-12Rβ2的结合,亲和力降低了超过100倍。将p35亚基上的Y189、I197/L198和F61突变成丙氨酸后,IL-12结合IL-12Rβ2的亲和力分别降低了大约68、32和22倍(图2C)。通过细胞信号转导实验,研究人员发现Y62A、Y189A和K192A突变体介导下游信号组分STAT4磷酸化的能力大大降低(图2D-E)。以上结果揭示了p35亚基上的Y62、Y189和K192是IL-12高亲和力结合特异性受体IL-12Rβ2和信号转导的结构和功能热点。
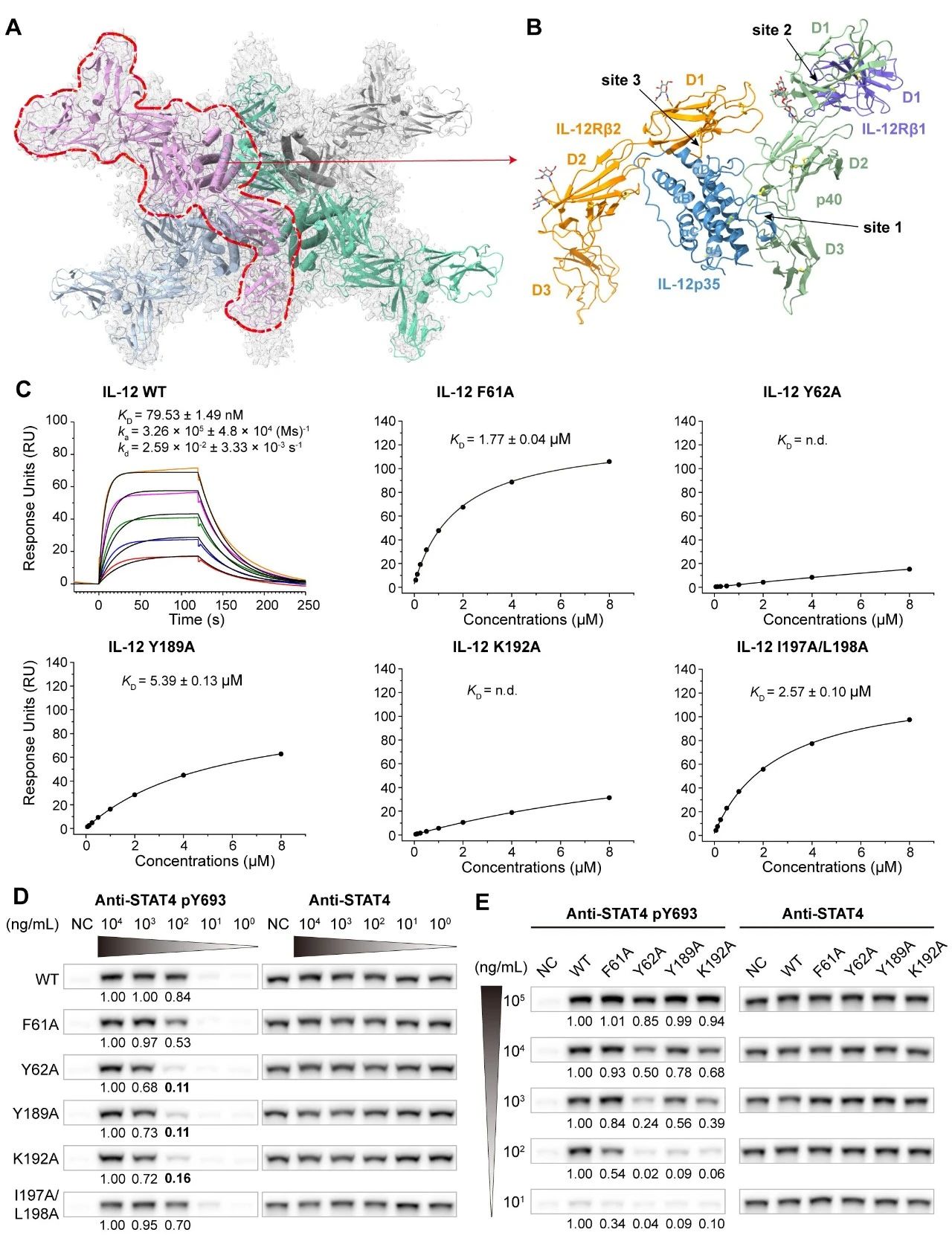
图2. (A-B)人源IL-12结合受体IL-12Rβ1和IL-12Rβ2的冷冻电镜结构;(C)IL-12突变体与IL-12Rβ2的亲和力检测;(D-E)IL-12突变体介导细胞STAT4磷酸化水平检测。
清华大学生命科学学院/北京生物结构前沿研究中心王新泉教授和2013级已毕业的曾建伟博士为本文的共同通讯作者;2018级博士生陈慧琴和2020级博士毕业生葛霄飞为主要工作完成者,实验室成员李春同学对本研究提供了重要帮助。电镜数据采集和计算工作在国家蛋白质科学研究(北京)设施的冷冻电镜平台和生物计算平台完成。本工作获得北京生物结构前沿研究中心、国家自然科学基金和国家重点研究计划的经费支持。









