人源肌酸转运体(Human Creatine Transporter, hCRT, SLC6A8)是一种位于细胞膜上的Na⁺/Cl⁻依赖性同向转运蛋白,介导肌酸进入细胞,在维持脑和肌肉组织的能量稳态中发挥核心作用。hCRT功能障碍会导致脑肌酸缺乏综合征(cerebral creatine deficiency syndrome 1, CCDS1),引发智力障碍、癫痫及语言发育迟缓等严重疾病。目前,hCRT相关疾病仍缺乏有效的治疗方式。另一方面,hCRT通过摄取肌酸维持代谢高度活跃肿瘤的ATP储备,因此也被视为抗癌药物研发的重要靶点。已有临床研究报道,处于II期临床试验的化合物RGX202作为hCRT的竞争性抑制剂,可诱导肿瘤细胞凋亡并抑制结直肠癌的生长。
2025年9月2日,清华大学/北京生物结构前沿研究中心杨茂君团队、北京大学医学部尚永丰院士团队及清博汇能生物科技有限公司张森森博士在《PNAS》发表合作研究论文Structural insights into the substrate uptake and inhibition of the human creatine transporter (hCRT)。该研究解析了hCRT在apo状态(hCRTapo)、底物结合状态(hCRTC)以及竞争性抑制剂RGX202结合状态(hCRTR)下的高分辨率冷冻电镜结构。研究者结合AlphaFold2建模与功能实验,揭示了hCRT的底物识别与转运机制和CCDS1相关致病突变对hCRT蛋白表达的影响。

在最新的研究中,该团队成功获得三种hCRT的高分辨率结构(hCRTapo, 3.28 Å; hCRTC, 2.85 Å; hCRTR, 2.75 Å),并揭示了不同构象下的离子结合特征。结构解析表明,hCRT采用NSS家族典型的LeuT-fold构型,其底物稳定位于由TM1与TM6构成的中央结合位点中。该成果为深入理解hCRT的动态转运机制及其在药物靶向干预中的应用奠定了重要的结构基础。
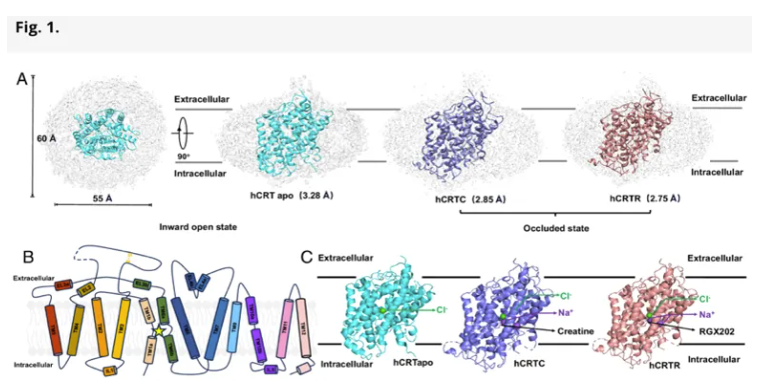
hCRT整体结构
hCRTC展示其底物结合口袋由多重氢键相互作用、芳香环残基的堆叠作用以及特有的Cys144协同稳定,从而实现了对肌酸的高亲和结合与有效转运。同时,结构表明Na⁺和Cl⁻共同形成稳定的离子配位网络,进一步稳定了底物结合并维持构象平衡。比较hCRTapo与hCRTC结构发现,TM1a发生显著位移,构成关键的“闸门”运动,介导底物从结合口袋的释放。这些结果揭示了hCRT在底物识别、离子协同及转运相关构象变化方面的分子基础,为理解其在能量代谢与疾病中的功能提供了关键结构学依据。此外,研究表明临床候选药物RGX202可模拟肌酸的结合构象,占据hCRT的底物结合口袋,并与关键残基形成稳定相互作用。与肌酸相比,RGX202具有更长的烷基链,可形成额外氢键并增强离子配位网络,从而提升结合稳定性。该独特机制揭示了RGX202如何特异性抑制hCRT与肌酸的结合,并为其抗癌作用提供了结构学解释。
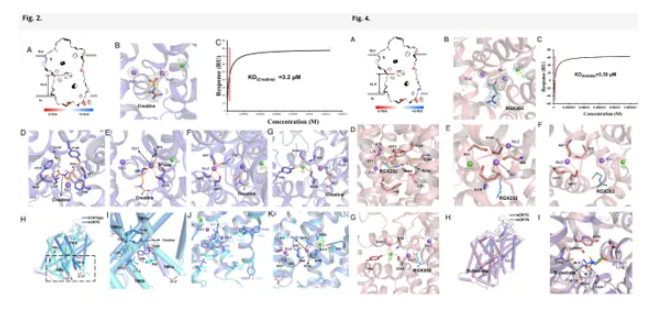
结合底物的hCRT复合体结构细节展示
研究发现,脑肌酸缺乏综合征(CCDS1)的致病突变并不是由于 hCRT 蛋白缺失引起,而主要源于其结构稳定性的破坏。不同类型的突变可能干扰离子结合位点、降低折叠稳定性或破坏跨膜螺旋间的构象耦合,从而削弱肌酸转运功能。这些结果为阐明 CCDS1 的分子机制及未来的靶向治疗策略提供了重要线索。
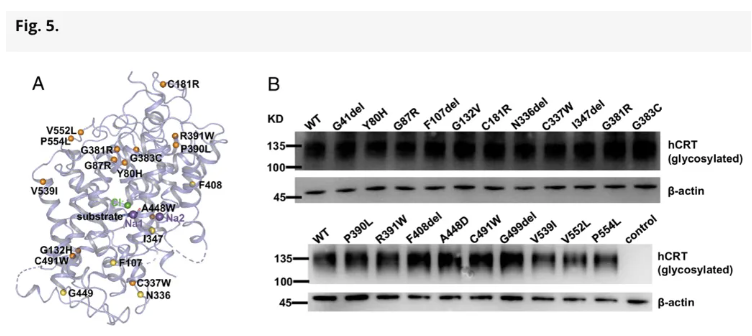
CCDS1相关突变的表达量验证
该研究揭示,不同构象之间的 hCRT 主要依赖 TM1a 与 TM6b 的“闸门运动”来介导底物释放。结合冷冻电镜结构与 AlphaFold2 预测结果,研究团队提出了一个整体转运模型:hCRT 在外向开放态结合肌酸,随后转变为阻塞态以稳定结合,最终通过胞内通路将底物释放至细胞质中。该模型为理解肌酸跨膜转运的分子机制提供了新的结构学视角。
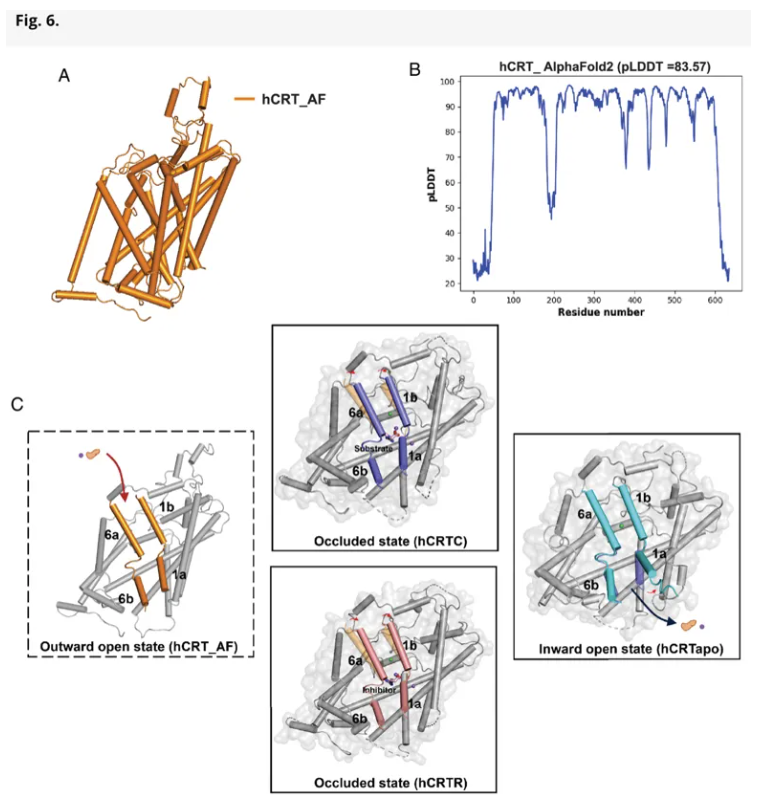
hCRT底物转运模型
清华大学/北京生物结构前沿研究中心杨茂君教授、北京大学医学部尚永丰院士和清博汇能生物科技有限公司张森森博士为文章的共同通讯作者。杭州师范大学2022级博士生苑欣怡、清华大学生命学院2023级博士生尹健、陈旭东博士、北京生命科技研究院刘畅博士为此文章的共同第一作者。该研究课题得到国家自然科学基金、重点研发计划、北京生命科技研究院(BLSA)、北京生物结构前沿研究中心、阿卜杜拉国王科技大学科技大学(KAUST)研究基金项目、浙江省自然科学基金等多个项目基金的支持。









