纤毛是进化上保守的细胞器,充当关键的信号中心,控制从感知到发育模式的各种生理过程。这些天线样结构的组装和维持依赖于鞭毛内运输(IFT),一种由运动蛋白和多亚基复合物介导的双向运输系统,可沿着基于微管的轴丝运送货物。在关键马达中,异源三聚体驱动蛋白 2 驱动正向运输,但其与IFT复合物耦合的分子机制仍未完全解决。
2025年9月17日, 清华大学生命科学学院/北京生物结构前沿研究中心欧光朔教授课题组在《Current Biology》发表题为“IFT88-KAP相互作用介导驱动蛋白-2与IFT耦合的保守机制”(IFT88-KAP interaction defines a conserved mechanism for kinesin-2-IFT coupling)的研究论文。该研究通过AlphaFold结构预测、系统突变筛选、线虫遗传互补与人类细胞验证等多项技术,首次揭示IFT88/OSM-5通过其TPR结构域与驱动蛋白-2的KAP亚基ARM重复区形成保守静电互作界面,直接介导驱动蛋白-2与纤毛内运输(IFT)机器的耦联。
研究团队通过AlphaFold预测筛选IFT复合物亚基与驱动蛋白-2的相互作用,发现IFT88/OSM-5与KAP之间存在高置信度的直接结合界面。进化分析显示,该相互作用模式在多个模式生物中高度保守。结构建模表明,IFT88的TPR结构域(α5、α7、α9螺旋)与KAP的ARM重复区(α3、α6、α9螺旋)形成电荷互补的嵌入式结合模式。
研究进一步通过系统突变筛选鉴定出核心功能残基:OSM-5的R246与D250(位于α7螺旋)分别与KAP-1的E177、Y134/R173形成盐桥和极性相互作用网络。线虫突变体回补实验表明,核心突变(如KAP-1-3M: Y134A/R173A/E177A)虽不影响蛋白质稳定性,但导致驱动蛋白-2无法进入纤毛;而IFT88-2M(R246A/D250A)突变体中驱动蛋白-2同样滞留于纤毛基部,证实该相互作用特异性调控kinesin-II的招募与激活。研究还发现,外围静电相互作用对复合体形成和IFT功能非必需,突显核心疏水与形状互补界面在耦联中的决定性作用。
人类细胞中的功能保守性实验表明,人源KAP同源突变(Y143A/R181A/E185A)导致其纤毛内信号下降约75%,与线虫表型高度一致,证明该机制在高等生物中广泛适用。
该研究首次解析了驱动蛋白-2与IFT机器的直接耦合机制,阐明IFT88-KAP作为进化保守的“分子桥梁”在纤毛组装中的核心作用,为纤毛发生障碍相关疾病的机制研究与靶向干预提供了新理论框架。
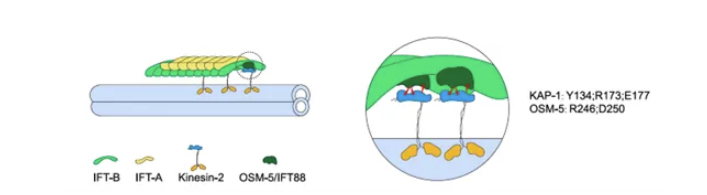
图1.驱动蛋白-2的KAP亚基与IFT复合物的IFT88亚基直接相互作用,通过核心相互作用网络实现驱动蛋白-2对IFT复合物的运输
清华大学生命科学学院/北京生物结构前沿研究中心欧光朔教授为该论文的通讯作者,清华大学生命科学学院2020级博士生陈广涵为第一作者。该研究工作得到了清华-北大生命科学联合中心、北京生物结构前沿研究中心、清华-IDG/麦戈文脑科学研究院、科技部、国家自然科学基金委等相关机构的支持与资助。









