2025.10.13~2025.10.19
CNS刊登文章
01
Nature
2025/10/15
“Hijacking a bacterial ABC transporter for genetic code expansion”
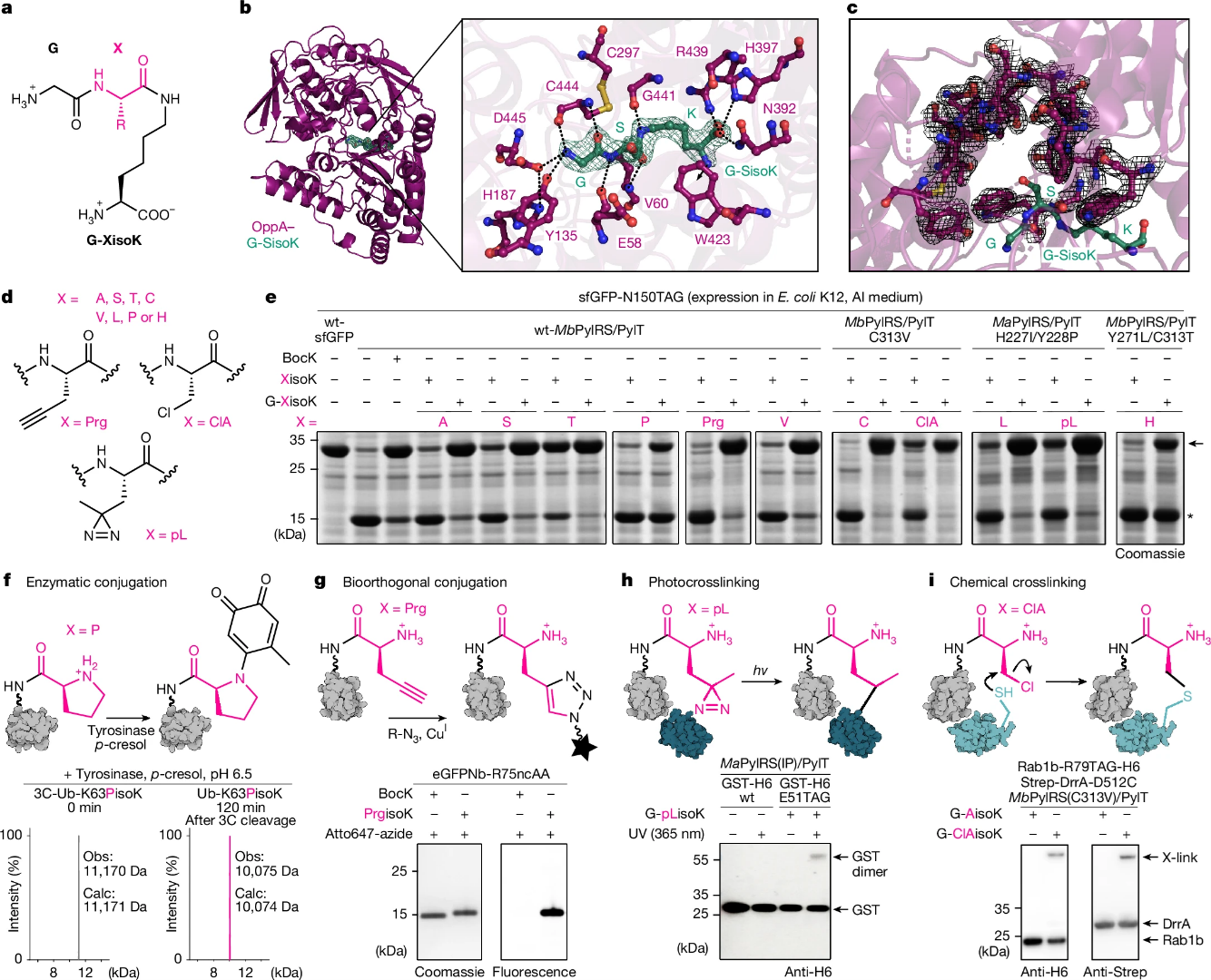
来自瑞士苏黎世联邦理工学院Kathrin Lang课题组发现细胞对ncAA摄取效率低是限制遗传密码扩展效率的主要障碍。为解决这一瓶颈,研究者 “劫持”了一种细菌的 ATP结合盒(ABC)转运蛋白,使其能够主动导入一种易于合成的异肽键连接三肽。这些三肽在细胞内被加工为ncAA,从而实现高效的ncAA导入与利用。通过这种方法,研究者能够高效地编码多种此前难以掺入的ncAA,使蛋白质可以被修饰上具有生物正交(bioorthogonal)或 交联(crosslinker)化学基团的结构单元,以及实现类似翻译后修饰的功能。此外,研究者建立了一个高通量定向进化平台,用于工程化改造专门的转运系统,以导入那些历史上难以被高效摄取的ncAA。表达这些改造型转运蛋白的大肠杆菌菌株能够以接近野生型的效率实现单位点或多位点的ncAA掺入。此外,研究者还对三肽骨架进行了改造,使其能够同时协同转运两种不同的ncAA,从而实现高效的双重掺入。综上所述,本研究表明:通过工程化改造细胞的摄取系统,可以实现对多种化学结构单元的可编程导入,为遗传密码扩展及蛋白质功能化提供了全新的策略。
02
Science
2025/10/16
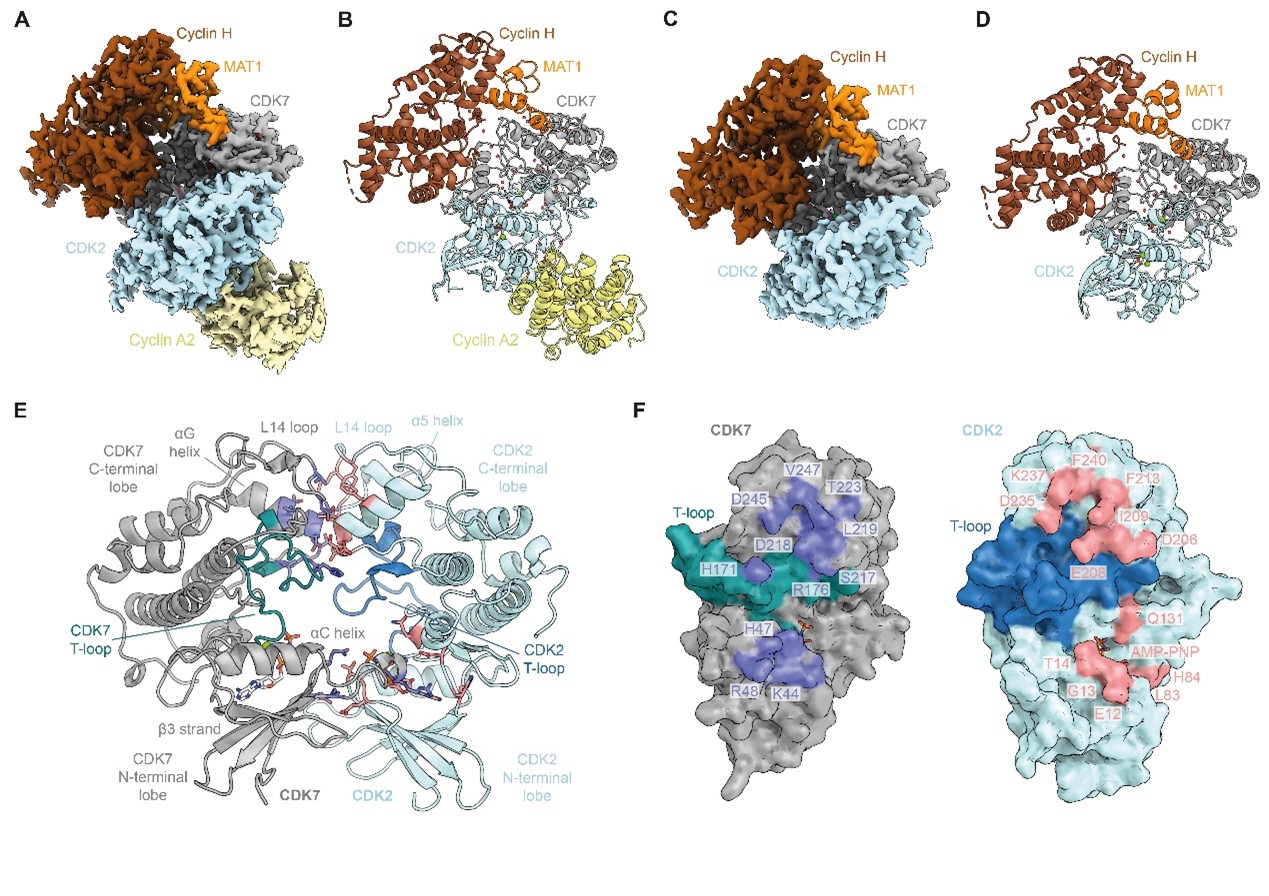
Cyclin-dependent kinases(CDKs,周期蛋白依赖性激酶)是细胞周期调控的典型调节因子。CDK 激活激酶(CAK)通过在 CDKs 保守的调控 T-loop 上的苏氨酸残基进行激活性磷酸化,从而起到主调节作用。然而,CAK 如何识别并激活 CDKs 的结构机制一直未被揭示。
来自英国伦敦癌症研究院的Basil J. Greber课题组利用冷冻电镜解析了 CAK 与 CDK2 以及 CDK2-cyclin A2 复合物的高分辨率结构。这些结构揭示了一种不依赖 T-loop 的激酶-激酶界面,其两侧激酶结构域均参与了相互作用。通过计算分析以及解析 CAK 与 CDK1-cyclin B1 及 CDK11 的复合物结构,研究者发现这些结构代表了 CAK-CDK 复合物的通用构架。这些结果拓展了我们对细胞周期调控及激酶信号级联机制的理解。
2025/10/16
2.“Kiss-shrink-run” unifies mechanisms for synaptic vesicle exocytosis and hyperfast recycling”
接吻-收缩-逃逸”机制统一了解释突触小泡外排与超快速回收的过程
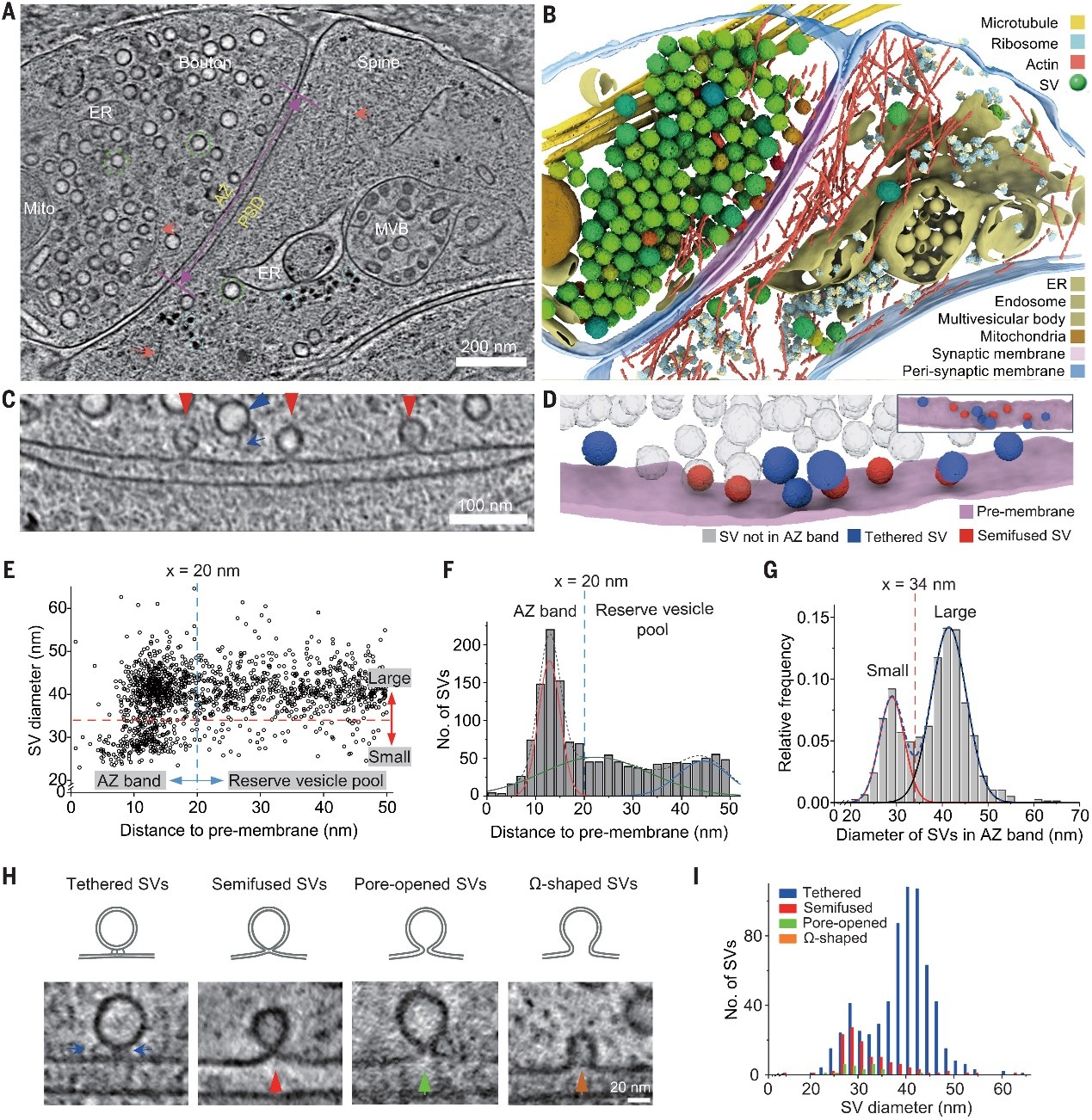
突触小泡(SV)的外排是神经元通讯的基础,但由于在原位条件下可视化快速事件的技术限制,其纳米尺度的动态过程仍然理解不足。
来自中国科学技术大学毕国强和刘北明联合美国加州大学洛杉矶分校周正洪团队合作通过结合光遗传学与时间分辨冷冻电子断层扫描技术,捕捉到了大鼠海马突触中SV外排的全过程。在突触激活后仅4毫秒内,SV会瞬间“接吻”质膜,形成一个约4纳米的脂质融合孔,孔的两侧由推测为 SNARE复合物 的结构所夹持。随后,SV迅速“收缩”,其表面积减少至原来的大约一半。到70毫秒时,大多数已收缩的SV通过一种“逃逸式(run-away)”途径回收,而其他的则完全塌陷并并入突触前膜。经过约 100毫秒,超快速的内吞作用会重新回收扩展后的突触前膜。这些发现揭示了一种 “接吻-收缩-逃逸”(kiss-shrink-run) 的SV外排与超快速回收机制,调和了此前存在争议的模型,并阐明了突触传递的高效性与精准性。
03
Cell
2025/10/16
“De novo designed voltage-gated anion channels suppress neuron firing”
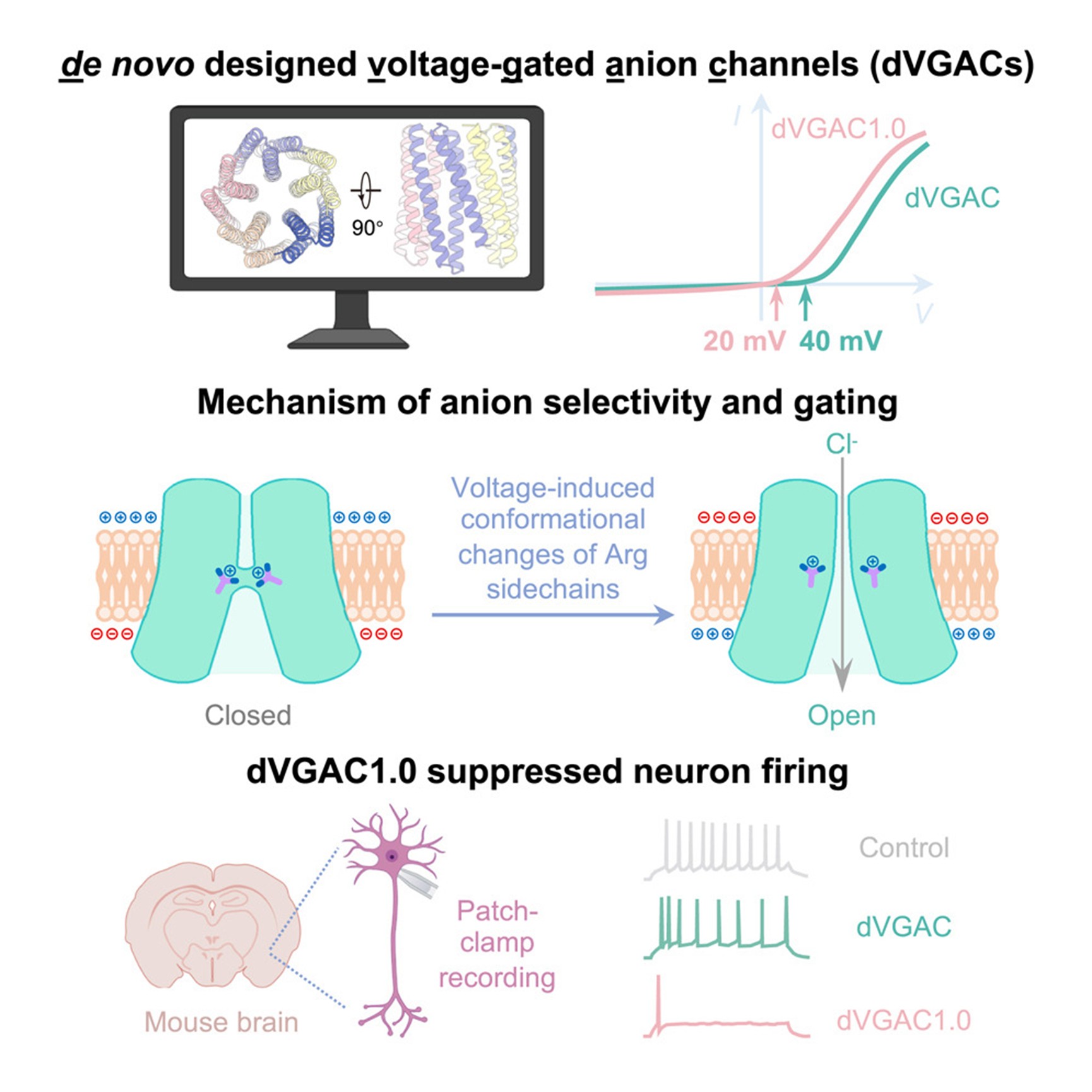
设计能够响应环境信号的离子通道,对于调控细胞活动和开发生物传感器具有重要意义。然而,由于刺激诱导的蛋白质构象变化设计极为复杂,这一直是一个重大挑战。
来自西湖大学卢培龙研究团队,联合西湖实验室/西湖大学李波、黄晶课题组合作从头精确设计了电压门控阴离子通道(de novo Voltage-Gated Anion Channels, dVGACs)。这些dVGACs采用由15个α螺旋组成的五聚体结构,在跨膜区域形成精确布置的精氨酸收缩区(arginine constrictions)。在膜片钳实验中,dVGACs 展现出电压依赖性的阴离子电流。冷冻电镜结构结果与设计模型高度一致。结合冷冻电镜结构与分子动力学模拟发现,精氨酸收缩区会发生电压诱导的构象变化,正如设计所预期的那样,同时充当电压传感器与选择性过滤器。值得注意的是,通过定点突变可以精确调控 dVGACs 的阴离子选择性与电压敏感性,从而在原位条件下实现抑制神经元放电的功能。这一成果展示了通过合理设计实现具有特定构象变化的离子通道的能力,不仅刷新了我们对膜生物物理学的理解,也为多种潜在应用(如神经调控与生物传感)开辟了新的方向。
2025.10.13~2025.10.19
子刊刊登文章
01
Cell Research
本周无
02
Molecular Cell
10.13
1.“Tuning insulin receptor signaling using de novo-designed agonists”
10.14
2.“Mechanisms of assembly and function of the Hsp70-Hsp40 chaperone machinery”
03
Nature Structural & Molecular Biology
10.14
“Structure and activation mechanism of a Lamassu phage and plasmid defense system”
04
Nature Communications
10.13
1.“ProFlex as a linguistic bridge for decoding protein dynamics in normal mode analysis”
10.13
10.13
3.“Room-temperature X-ray fragment screening with serial crystallography”
10.13
10.13
5.“Structural basis of measles virus polymerase inhibition by nonnucleoside inhibitor ERDRP-0519”
10.14
6.“Discovery and mechanism of a highly selective, antifungal acetyl-CoA synthetase inhibitor”
10.14
7.“Molecular landscape of the fungal plasma membrane and implications for antifungal action”
10.15
10.15
9.“Structural basis of K11/K48-branched ubiquitin chain recognition by the human 26S proteasome”
10.16
10.“Structural insights into the secretin complex of a type IVb pilus system”
10.16
10.17
12.“AQuaRef: machine learning accelerated quantum refinement of protein structures”
10.17
13.“Seed structure and phosphorylation in the fuzzy coat impact tau seeding competency”
10.17
14.“Visualization of lysosomal membrane proteins by cryo electron tomography”
10.17
05
Science Advances
10.15
1.“Structure and quenching of a bundle-shaped phycobilisome”
10.17
2.“Ultrafast, remote-controlled protonation reaction enables structural changes in a phytochrome”
10.17
3.“Structures of rotary ATP synthase from Thermus thermophilus during proton powered ATP synthesis”









