在真核生物中,DNA缠绕在组蛋白上形成核小体,经高度压缩形成染色质。这一形式一方面保证了基因组的稳定性,另一方面阻碍了诸如遗传信息的复制,转录和DNA损伤修复等生命活动。因此,染色质的动态调控对于生物具有重要作用。染色质重塑Snf2-家族马达蛋白利用ATP的能量滑动、弹出、交换或解聚核小体来,从而实现对染色质的动态调控。
BAF(BRG1-associated factors)和PBAF(polybromo-associated BRG1-associated factors)是哺乳动物SWI/SNF家族的染色质重塑复合物, 它们调控染色质结构和基因表达,广泛参与动物细胞的发育分化过程。近年来,随着高通量测序技术的发展,科研人员发现BAF/PBAF复合物的突变与超过20%的癌症,及多种神经系统发育缺陷有关。BAF/PBAF被认为是治疗癌症等重大人类疾病的潜在药物靶点。因此SWI/SNF家族复合物被广泛关注和研究。尽管早在1996年,BAF/PBAF复合物就已经被鉴定出来,但对于其组装方式和染色质重塑机制一直都不清楚。得益于冷冻电镜技术的发展,酵母SWI/SNF家族复合物及人源BAF复合物的高分辨结构先后在2019和2020年被报道。然而,对于PBAF复合物的组装方式,识别核小体的机制,其与BAF复合物的差异等问题还尚待研究。尤其是已报道的BAF复合物的核心马达亚基(SMARCA4/BRG1)处于非活性状态,不能准确解析许多与疾病相关突变的致病机理。
陈柱成教授研究团队长期深耕于染色质重塑领域,发表了一系列重要成果。在此基础上,研究团队克服技术难点,不断突破,通过体外重组的方法获得了高质量的PBAF复合物,利用冷冻电子显微镜技术,解析了PBAF结合核小体的高分辨结构(3.4埃)。
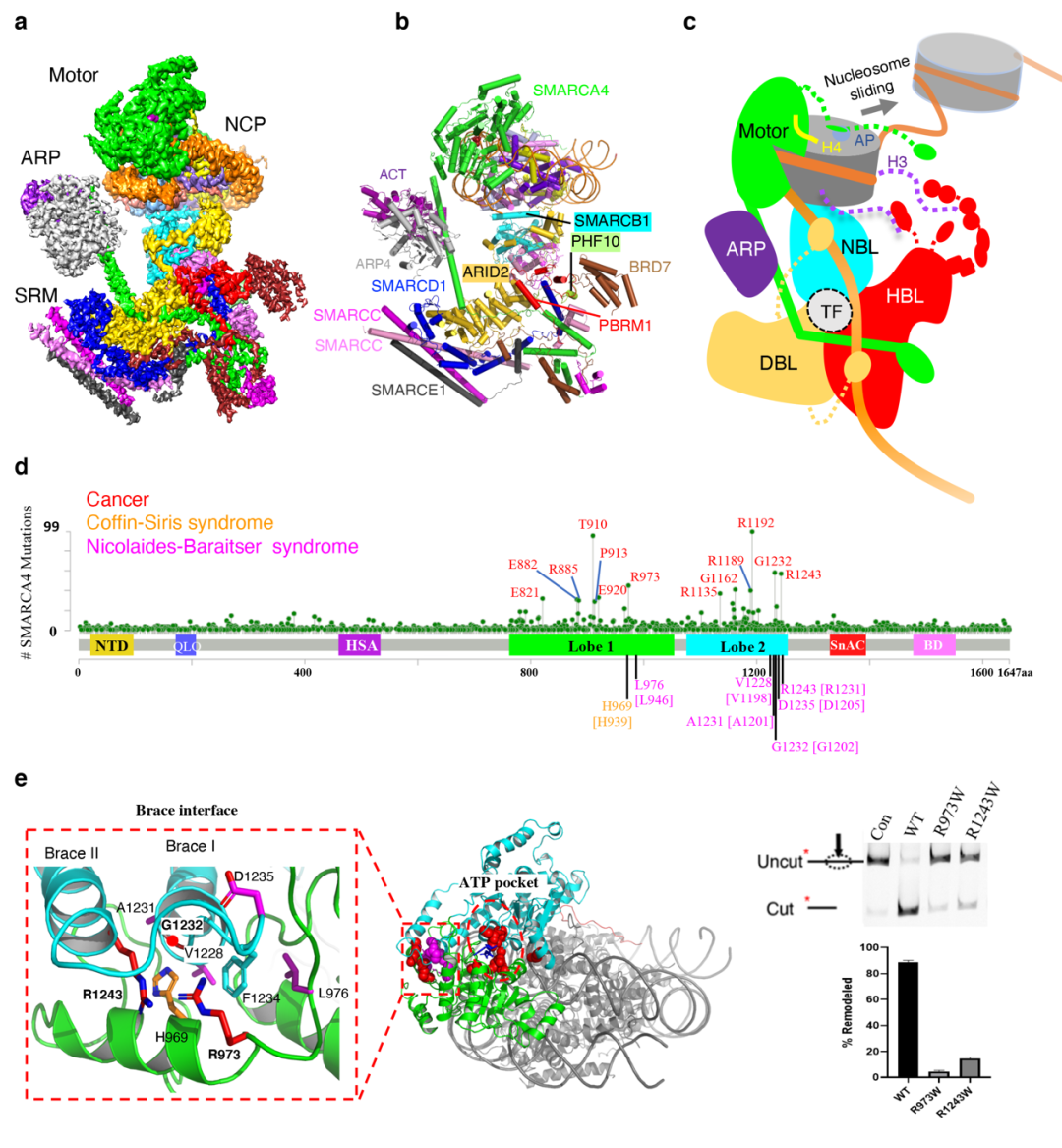
PBAF染色质重塑复合物结合核小体的结构和疾病相关突变
(a)PBAF-核小体复合物的冷冻电镜密度图。
(b)PBAF-核小体复合物的结构模型。
(c)PBAF复合物识别核小体,调控染色质结构的模型。
(d)癌症及神经系统发育缺陷综合征相关相关的SMARCA4/2的错义突变位点分布(数据来自COSMIC,cBioPortal和已发表文献)。以SMARCA4序列为参考,标记高频突变位点;SMARCA2突变的对应氨基酸残基在[ ]里。
(e)疾病相关的突变位点主要位于“ATP pocket”周围和“Brace interface”,局部放大图显示了高频突变位点在Brace-helix界面的分布,右图生化实验显示R973和R1243的突变大大降低了染色质重塑活性。
值得注意的是,本研究解析的复合物中马达亚基SMARCA4处于活性状态。在此结构中,我们可以清楚地看到疾病相关的突变主要位于高度保守的ATP结合口袋周围,和新形成的Brace-helix界面。Brace-helix活性界面介导了两个马达结构域(Lobe1与Lobe2)的相互作用,是耦合ATP水解和核小体滑动的关键元件,由陈柱成研究组于2017年首次在酵母染色质重塑蛋白Snf2中发现。在PABF的研究工作中,他们发现多个与癌症相关的SMARCA4高频突变热点就位于新形成的Brace-helix界面。而且,多个发生在旁系同源蛋白SMARCA2中与神经系统发育缺陷相关的突变也分布在这个界面。生化实验证实了这些位点的突变会显著降低染色质重塑活性,这提示病人的BAF/PBAF复合物功能的丧失。另外,高质量的电镜密度首次揭示了SMARCA4亚基的SnAc 结构域识别核小体的机制:SnAc通过3个“arginine anchor”识别核小体的酸性口袋(acidic pocket, AP),促进染色质重塑活性。
总之,这项工作不仅阐明了PBAF复合物组装、核小体识别和染色质重塑机制,而且为理解BAF/PBAF相关突变的致病机理提供了理论基础。这一发现有利于在染色质水平理解染色质重塑机制,也会推动相关疾病靶向药物的研发。
清华大学结构生物学高精尖创新中心陈柱成教授为本文的通讯作者。清华大学生命科学学院/清华-北大生命科学联合中心2019级博士生袁俊杰和2017级博士生陈康净为本文共同第一作者,博士后张文博也参与了重要工作。本工作获得国家自然科学基金、科技部重大科学研究计划专项、北京市结构生物学高精尖创新中心、北京生物结构前沿研究中心、清华-北大生命科学联合中心、国家蛋白质科学研究(北京)设施清华基地的大力支持。
原 文 链 接
https://www.nature.com/articles/s41586-022-04658-5









