早在2014年,北京生物结构前沿研究中心俞立团队在 Cell Research 发表论文【1】,发现了一种新的细胞器——迁移体(Migrasome),此后,俞立团队发表多篇论文,进一步揭示了迁移体的产生机制及其功能。
2021年5月,俞立团队在 Cell 发表论文【2】,将新型细胞器迁移体与线粒体联系了起来,该研究发现并命名了细胞内的一种之前未知的现象——Mitocytosis(线粒体胞吐),在轻度线粒体应激后,受损的线粒体会被转运到迁移体(Migrasome)中,再被迁移体运送到细胞外。俞立团队认为,这是细胞对线粒体的一种质控过程,把受损的线粒体清理出去,因此,在功能上,Mitocytosis(线粒体胞吐)对维持线粒体质量起重要作用。
2022年5月4日,北京生物结构前沿研究中心俞立团队在 Cell Research 发表了题为:Retractosomes: small extracellular vesicles generated from broken-off retraction fibers的论文。
该研究发现,细胞迁移过程中由断裂的收缩丝(Retraction Fibers,RF)产生的一种之前未被报道的膜状结构,并将其命名为——Retractosomes(收缩丝体)。

在之前的研究中,俞立团队就发现,细胞在迁移过程中会产生收缩丝(Retraction Fibers,RF)和迁移体(Migrasome),细胞迁移离开后,大量收缩丝从细胞中脱落并遗留下来,这些收缩丝离开细胞后的命运如何,目前尚不清楚。
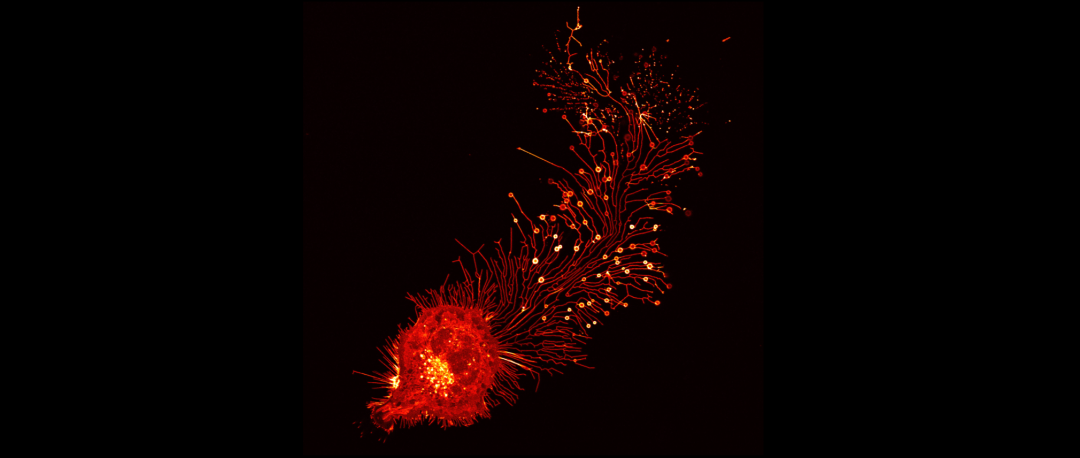
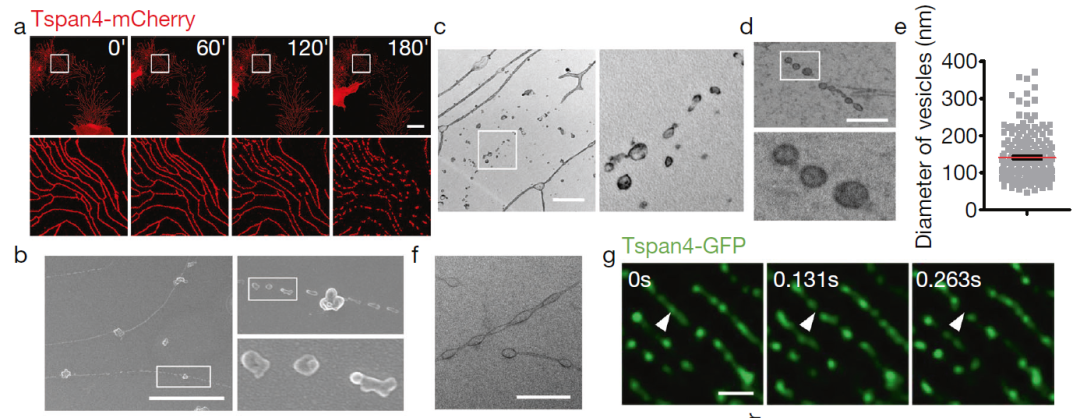
为了研究这些收缩丝的命运,研究团队在小鼠成纤维细胞(L929细胞)中观察发现,在迁移过程中,收缩丝被拉出,并很快在末端或交叉点上生成迁移体。整个过程中,Tspan4(迁移体标记蛋白)沿收缩丝均匀分布。随着细胞不断迁移,这些收缩丝断裂,迁移体也从细胞上脱离。此时,Tspan4 沿着被收缩丝占据的路径显示为大量的小斑点。
接来下,研究团队使用扫描电镜对对这些收缩丝斑点进行了进一步分析,发现在收缩丝的远端留下大量圆形的小细胞外囊泡,通常这些囊泡像一串珠子一样连接在一起。进一步的透射电子显微镜观察显示,这些囊泡具有连续膜结构,所以它们是真正的囊泡,而不是细胞膜碎片。冷冻透射电镜分析进一步证实这些收缩丝斑点是小的细胞外囊泡。
而且,这些囊泡比迁移体要小得多,直径在50nm-250nm不等。这些数据表明,当收缩丝断裂后,它们会形成一种以前未报道过的细胞外囊泡。
与迁移体类似,这些小的细胞外囊泡是迁移依赖性的,且起源于收缩丝和细胞质膜,因此,研究团队将其命名为——Retractosomes,中文名暂译为收缩丝体。
俞立团队之前的研究证实,Tspan4 的过表达可以显著增强迁移体和收缩丝的形成。在这项研究中,研究团队在 L929细胞(一种小鼠成纤维细胞)中过表达了 Tspan4-GFP,结果显示,与迁移体类似,收缩丝体中富集了 Tspan4-GFP,Tspan4 的过表达显著增强了迁移体和收缩丝体的形成,对收缩丝体的促进主要是由于增强了收缩丝的形成。
迁移体由富含胆固醇和四跨膜蛋白的大结构域组装而成,胆固醇的消耗会抑制迁移体的形成。而这项研究显示,胆固醇消耗促进收缩丝体的形成,这说明取决于 Tspan4 而不是胆固醇,这与迁移体的形成不同。
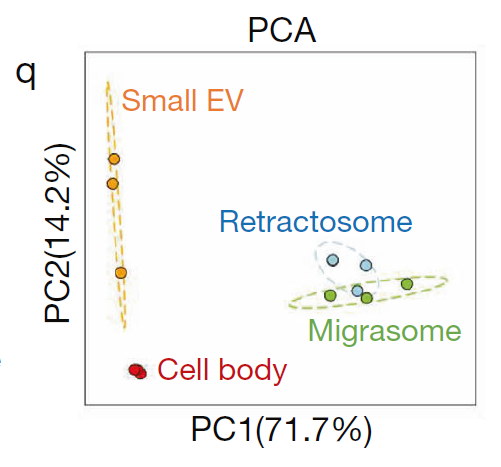
在形态学上,收缩丝体明显小于迁移体,但略大于小细胞外囊泡。此外,小细胞外囊泡的三个标记物——Tsg101、CD63 和 Syntenin-1蛋白,在收缩丝体中水平非常低。
接下来,研究团队对收缩丝体进行质谱分析,分析结果显示,收缩丝体的蛋白质谱与细胞体蛋白质谱显著不同,与细胞体相比,收缩丝体中有1107种蛋白质水平更高,有1309种蛋白质更低。研究团队还对小细胞外囊泡和迁移体进行了定量质谱分析,结果显示收缩丝体蛋白质组成与迁移体具有明显相似性,但与小细胞外囊泡非常不同。
总的来说,该研究发现了细胞迁移过程中由断裂的收缩丝(Retraction Fibers,RF)产生的一种之前未被报道的膜状结构,并将其命名为——Retractosomes。而其具体的生理功能目前还有待进一步研究确定。









