神经酰胺是一类重要的脂类信号分子,参与了细胞凋亡、衰老、增殖、自噬与血管再生等一系列重要的生理过程[1]。在细胞中,鞘磷脂酶水解鞘磷脂是神经酰胺生成的主要途径。根据催化所需的最适pH值、阳离子依赖性、细胞亚定位与序列同源度等特征,胞内的鞘磷脂酶又可被分为酸性,中性与碱性鞘磷脂酶[2]。SMPD2是主要表达于细胞核和内质网上的中性鞘磷脂酶。多项研究表明SMPD2与神经酰胺积累所引发的细胞凋亡过程相关。除此以外,提高SMPD2蛋白的表达水平会显著抑制肝癌细胞的增殖[3]。然而,在SMPD2敲除的MCF-7细胞中,SMPD2的缺失并不会引起神经酰胺含量的显著变化[4]。鉴于SMPD2在维持细胞稳态和程序性细胞死亡中起着至关重要的作用,对于其催化与调控过程分子机制的探究,将有助于提高我们对神经酰胺代谢途径及SMPD2对细胞生理学影响的认识。
2023年11月27日,清华大学/北京生物结构前沿研究中心杨茂君课题组与中国科学院大连化学物理研究所李国辉课题组合作在Nature Communications杂志发表题为Molecular basis for the catalytic mechanism of human neutral sphingomyelinases 1 (hSMPD2)的研究论文。该研究综合结构生物学、生物化学,细胞生物学与计算生物学等,系统性地揭示了SMPD2的催化过程与调控机理,相关机制的研究有望为肝癌等疾病的药物开发提供新助力。

杨茂君课题组通过单颗粒冷冻电镜技术成功解析了第一个全长的人源中性鞘磷脂酶SMPD2的原子分辨率结构。不同于前人解析的单体形式的酸性与碱性鞘磷脂酶,人源SMPD2通过C末端的跨膜螺旋之间的相互作用形成稳定的二聚体结构,且在二聚体作用界面的空腔内存在稳定二聚体结构的脂质分子(图1a-b)。二聚体作用界面上的E92A突变会显著降低蛋白的表达水平,其次,与脂类分子存在相互作用的W112A与F113A突变,均会显著降低蛋白水解活性(图1c-d)。在SMPD2反应活性中心内存在着一个Mg2+,与Mg2+直接作用的N15与E49突变均会使蛋白丧失催化活性,表明Mg2+对于催化过程至关重要(图2a-b)。进一步的,研究人员对保守的SMPD2D111-K116形成的D-K loop结构域进行探究,结果表明,D-K loop在催化过程中起到类似开关的作用,当D111-K116形成的α-螺旋被破坏后,这段柔性结构会位移到底物结合口袋开口处,阻碍底物进入活性中心(图2c-d)。

图1 人源SMPD2蛋白的整体结构与二聚体作用界面分析
李国辉课题组在已有结构的基础上,通过分子动力学模拟探究了鞘磷脂与SMPD2的结合形式与水解过程(图3a-d)。结合突变体的酶活实验,确定了底物结合口袋内N15,E49,K116,D178,H272等一系列与水解相关的关键氨基酸。进一步的,研究人员通过分子动力学模拟,探究了SMPD2在催化底物鞘磷脂与潜在底物溶血血小板因子(lyso-PAF)水解过程中存在的差异性。结果表明,相较于底物鞘磷脂,在催化lyso-PAF水解时,SMPD2需要克服更大的能垒。生化实验结果也表明,SMPD2与底物鞘磷脂有着更高的亲和力。
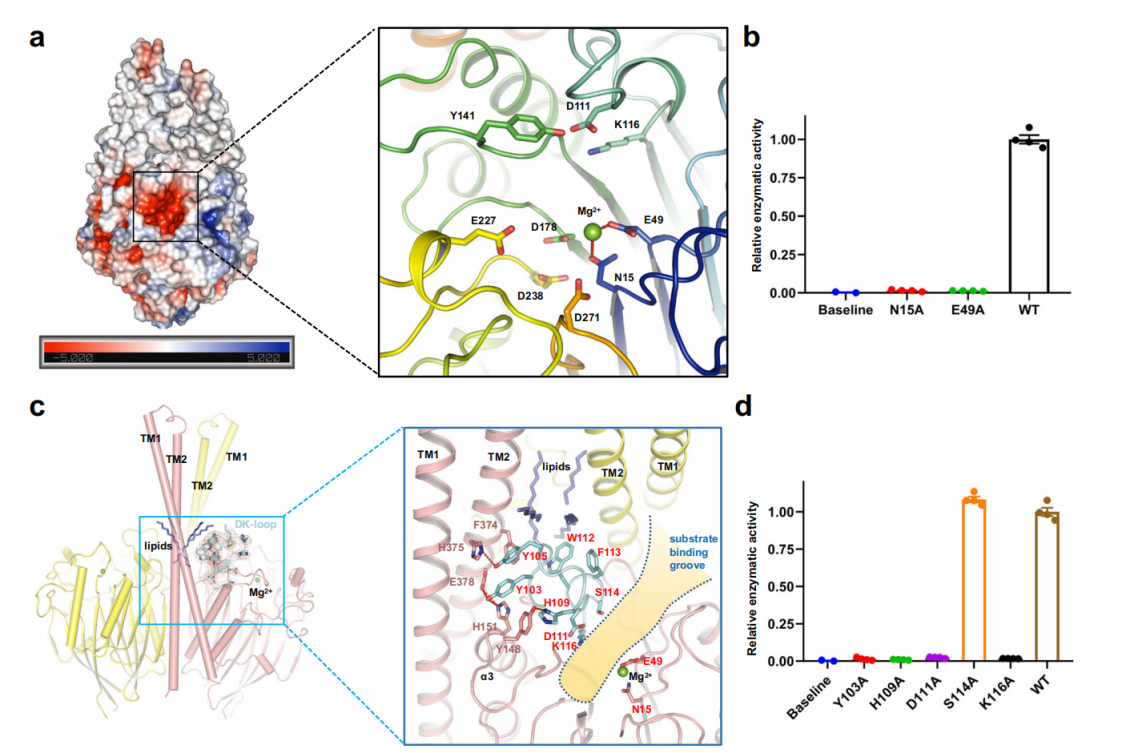
图2 人源SMPD2的底物结合口袋与D-K loop结构
综上,本研究加深了人们对中性鞘磷脂酶及神经酰胺相关代谢通路的理解,揭示了SMPD2的催化过程与调控机理,并为针对中性鞘磷脂酶为靶点的药物研发与改造提供了重要的依据。
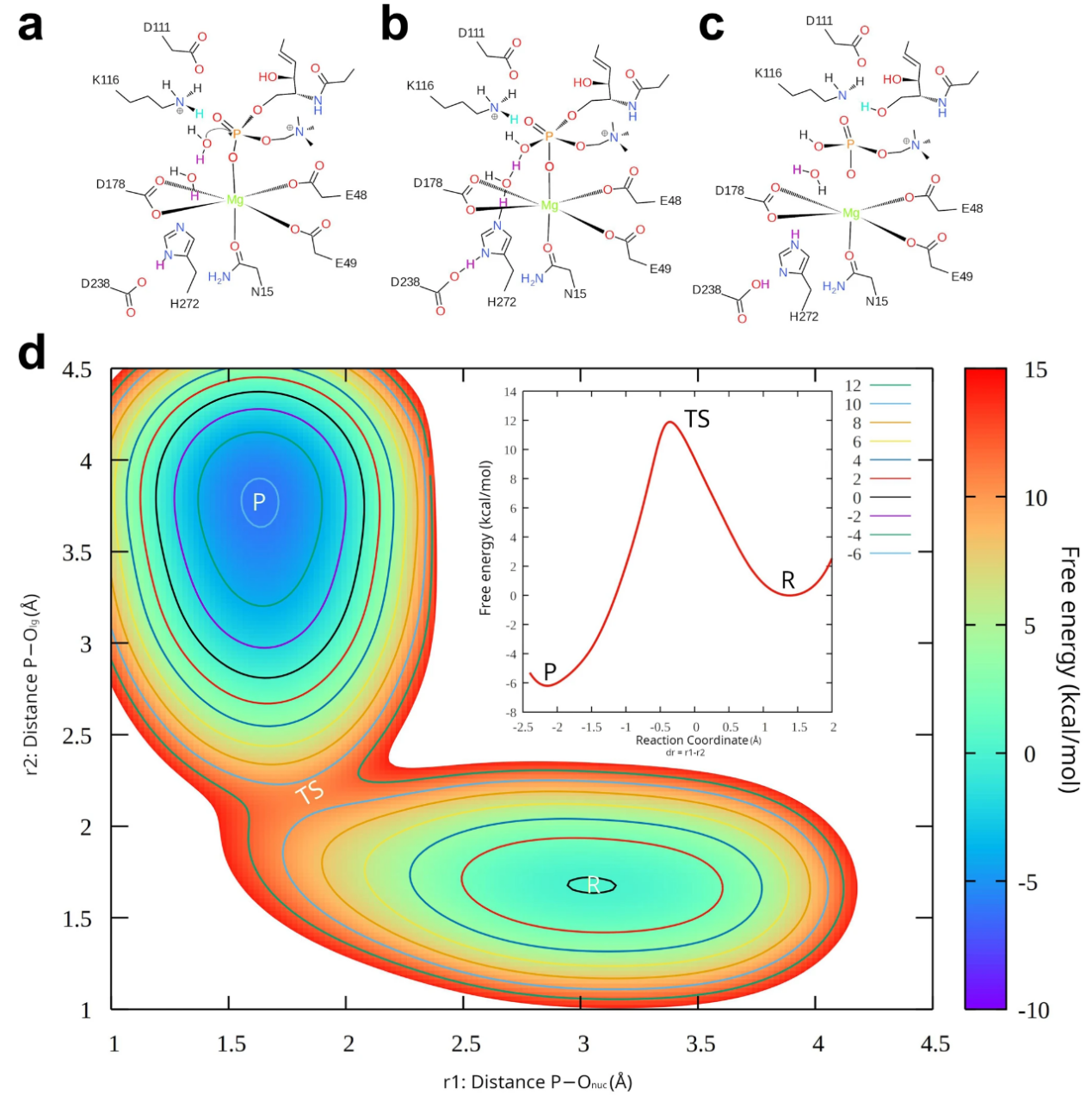
图3 SMPD2催化鞘磷脂水解过程图示
清华大学/北京生物结构前沿研究中心杨茂君教授,张森森博士以及中国科学院大连化物所张跃斌副研究员为本文共同通讯作者。清华大学易静波博士,2019级博士生綦博雅,2023级博士生尹健为本文共同第一作者。清华大学李若翀博士,陈旭东博士,2022级博士生胡峻涵和大连化物所李国辉研究员为本研究提供了大力支持。本研究课题得到国家自然科学基金、国家重点研发计划、清华北大生命科学联合中心基金、北京生物结构前沿研究中心、阿卜杜拉国王科技大学(KAUST)研究基金、清华-佛山创新专项基金项目等多个项目基金的支持。









