在神经科学研究中,实时、精准地监测多种神经递质的动态变化,一直是理解大脑功能与疾病机制的关键。近年来,神经递质成像技术飞速发展,其中以GRAB传感器系统为代表的一类工具,通过将识别特定递质的G蛋白偶联受体(GPCR)与循环排列荧光蛋白(cpFP)融合,当神经递质结合GPCR后引发构象变化,进而改变cpFP荧光强度,实现信号可视化。这类传感器已广泛应用于多巴胺(GRABDA)、乙酰胆碱(GRABACh)、ATP 等多种递质的体内成像。
然而,传统GRAB传感器多集中于绿色和红色光谱,不仅存在光谱重叠严重、通道扩展受限等问题,而且荧光蛋白亮度有限、体内信噪比偏低,限制了其在多通道、深层组织成像中的应用。

HaloDA1.0 的原理与构建
HaloDA1.0基于一种化学遗传策略构建:研究者将环化的HaloTag(cpHaloTag)嵌入 D1R 的第3胞内环(ICL3),并与可穿膜的远红荧光染料(如SiR650)共价结合。HaloTag 染料在结合蛋白后,其荧光性能会因微环境极性改变而增强。D1R 受体结合多巴胺后构象变化,可传导至cpHaloTag,引发荧光增强,实现信号检测。
研究团队通过插入位点筛选、linker优化、HaloTag工程改造及GPCR点突变优化,最终构建出性能优异的HaloDA1.0,其在HEK293T细胞中对DA响应灵敏(EC₅₀ ≈150 nM)、ΔF/F₀ 可达9倍,且不响应NE、5-HT、GABA等其他神经递质。功能验证也证实其不会激活G蛋白或β-arrestin通路,适合作为成像而不干扰功能的理想工具。
研究者在神经元中共表达HaloDA1.0(远红)、r5-HT1.0(红色5-HT传感器)与NE2m(绿色去甲肾上腺素传感器),并进行共聚焦三色成像,结果显示三者在同一细胞内可分别响应各自激动剂,无明显光谱串扰,为多递质成像提供了实用路径。(图1)
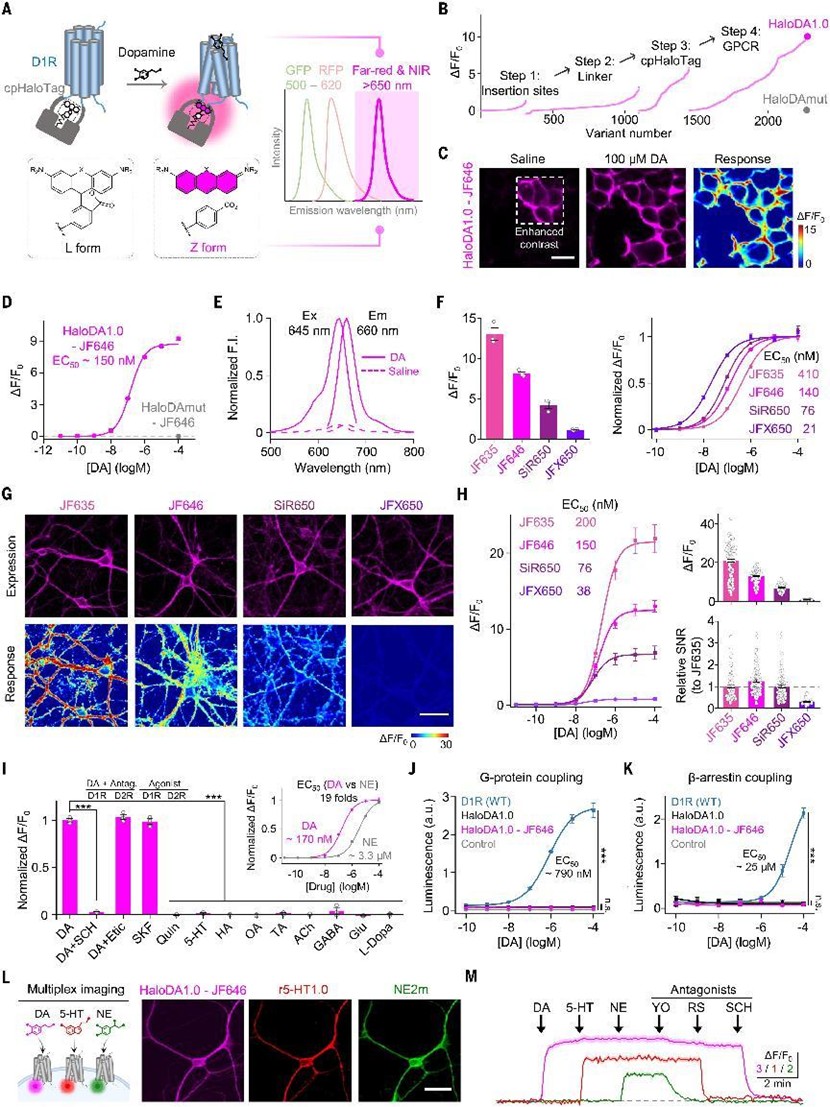
图1 HaloDA1.0设计与体外验证
小鼠脑切片中三种神经递质的同时监测
在小鼠伏隔核(NAc)注射AAV载体表达HaloDA1.0、GRABACh、GRABeCB,分别用SiR650、红光和绿光染料标记,在急性脑片中实现DA、ACh、eCB的三通道成像。三种信号均可被各自的拮抗剂特异性阻断,响应动力学显示DA和ACh属快速突触释放,eCB则响应较慢,表明其需合成后释放。进一步的药理实验显示,DA可通过D2R抑制ACh释放,而胆碱酯酶抑制剂Donepezil可增强ACh并反馈促进DA释放,也可能间接影响eCB,提示三种递质存在复杂互调机制。(图2)
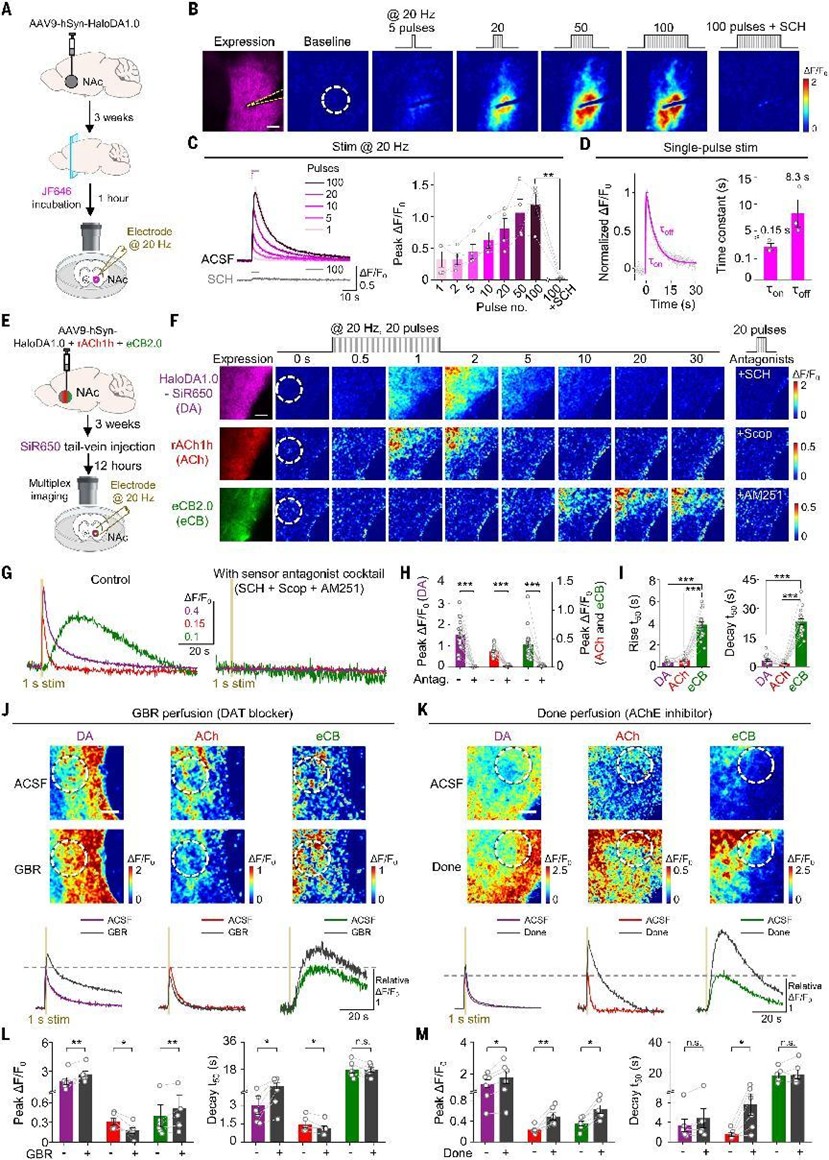
图2 使用HaloDA1.0对急性小鼠脑切片进行多重成像
HaloDA1.0在斑马鱼的体内应用
研究者在斑马鱼脑中瞬时表达HaloDA1.0,并筛选不同染料的体内表现,发现SiR650具有最高信噪比与膜定位清晰度。DA局部喷注可诱导荧光增强。进一步在同时表达HaloDA1.0、红色Ca2+传感器(jRGECO1a)和绿色ATP传感器(ATP1.0)的模型中,实现了DA、Ca2+和ATP的三色同步成像,且在电刺激或 PTZ 处理后三信号均同步上升,DA与ATP衰减均慢于Ca2+,暗示了三者调控时程与功能定位的不同。(图3)
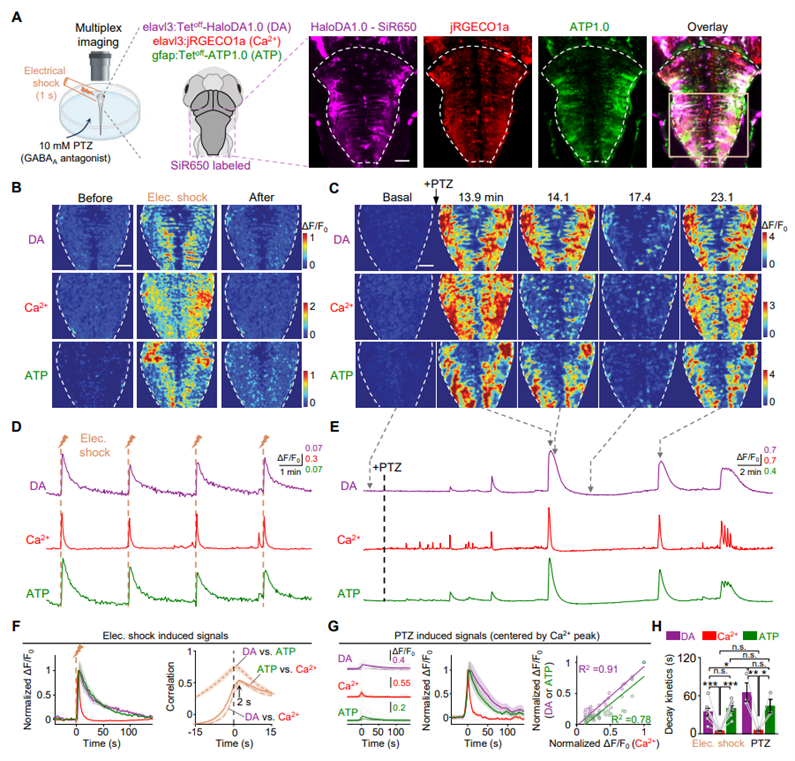
图3 在斑马鱼中进行多重成像
小鼠体内DA动态追踪与区域差异验证
与斑马鱼相比,小鼠体内成像面临更大挑战,尤其是染料的血脑屏障通透性问题。作者系统评估多种染料,最终选用SiR650并结合HaloDA1.0进行在体实验。通过光遗传手段,作者成功验证HaloDA1.0可在小鼠NAc脑区记录频率与时间依赖性的DA释放信号,且可被GBR增强、D1R拮抗剂SCH23390阻断。在mPFC、CeA等区域亦可记录DA信号,在D2R-Cre小鼠中表达HaloDA1.0与Ca2+传感器,发现DA释放抑制了D2R阳性神经元的Ca2+活性,该效应可被D2R拮抗剂解除,提示D2R介导的抑制调控作用。
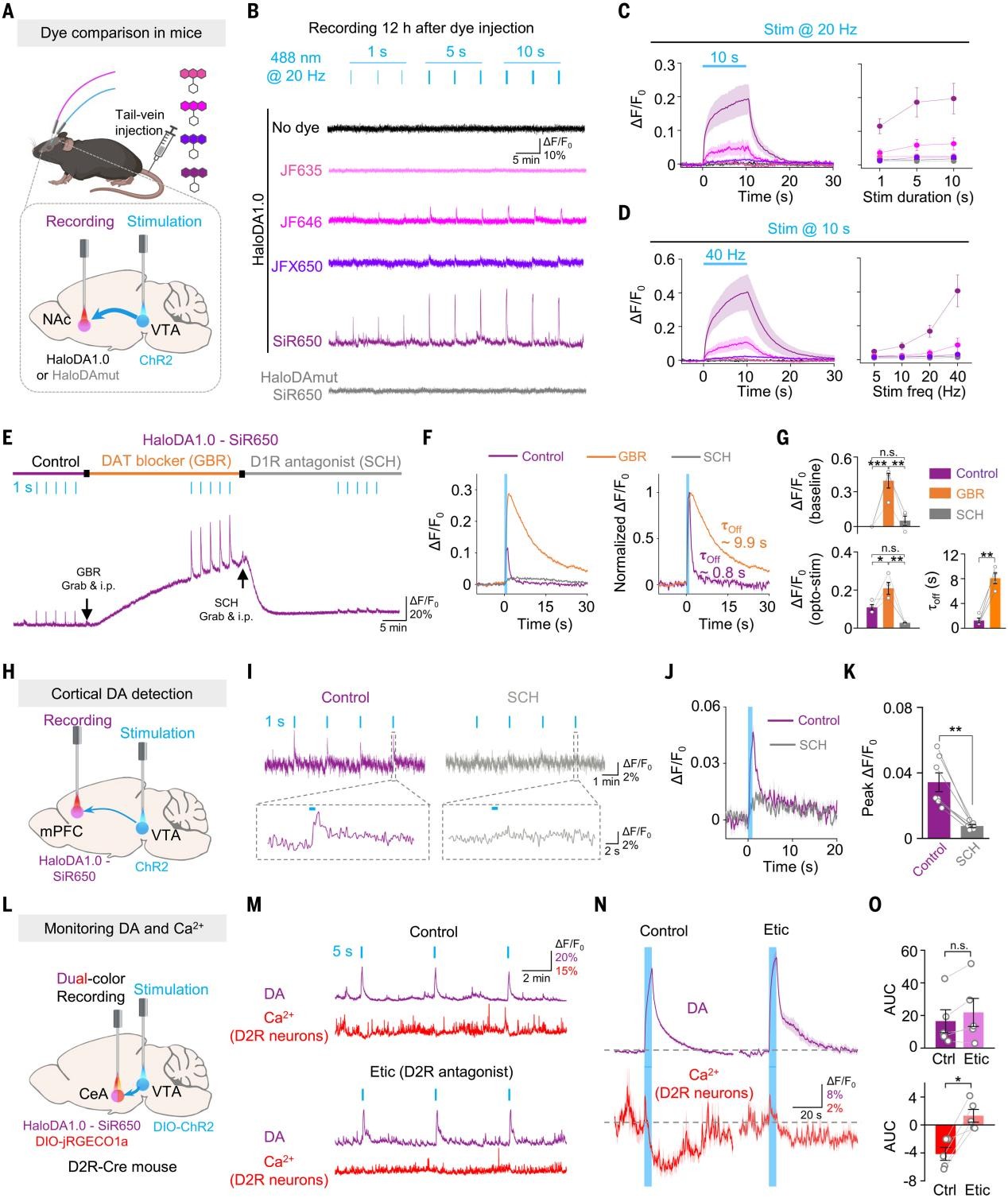
图4 HaloDA1.0可用于检测自由运动小鼠内源性DA的释放
奖赏/惩罚行为诱导下的三信号动态解码
在纹状体中,DA和ACh都在学习和动机中发挥重要作用,部分通过分别结合在中棘神经元(D1-MSNs)上表达的兴奋性D1R和抑制性毒蕈碱乙酰胆碱M4受体(M4R)来调节突触可塑性,但它们在D1-MSN中对细胞内cAMP信号传导的同步调节作用仍不太清楚。为了解决这一重要问题,作者在D1R-Cre小鼠的NAc中同时表达三个传感器:HaloDA1.0、rACh1h和绿色荧光cAMP传感器DIO-GFlamp2。使用光纤光度法记录分析三信号在奖赏(蔗糖)、惩罚(电击)与可卡因处理下的动态协同模式。结果显示:蔗糖诱导DA和cAMP同步上升,ACh下降;电击诱导DA和cAMP下降,ACh上升;可卡因处理下三者同时上升。时序分析显示:DA领先cAMP,ACh抑制cAMP,符合D1R-Gs与M4R-Gi的经典信号通路;但可卡因处理打破这种平衡,提示其通过扰乱DA/ACh协同机制影响动机与奖赏回路。(图5)
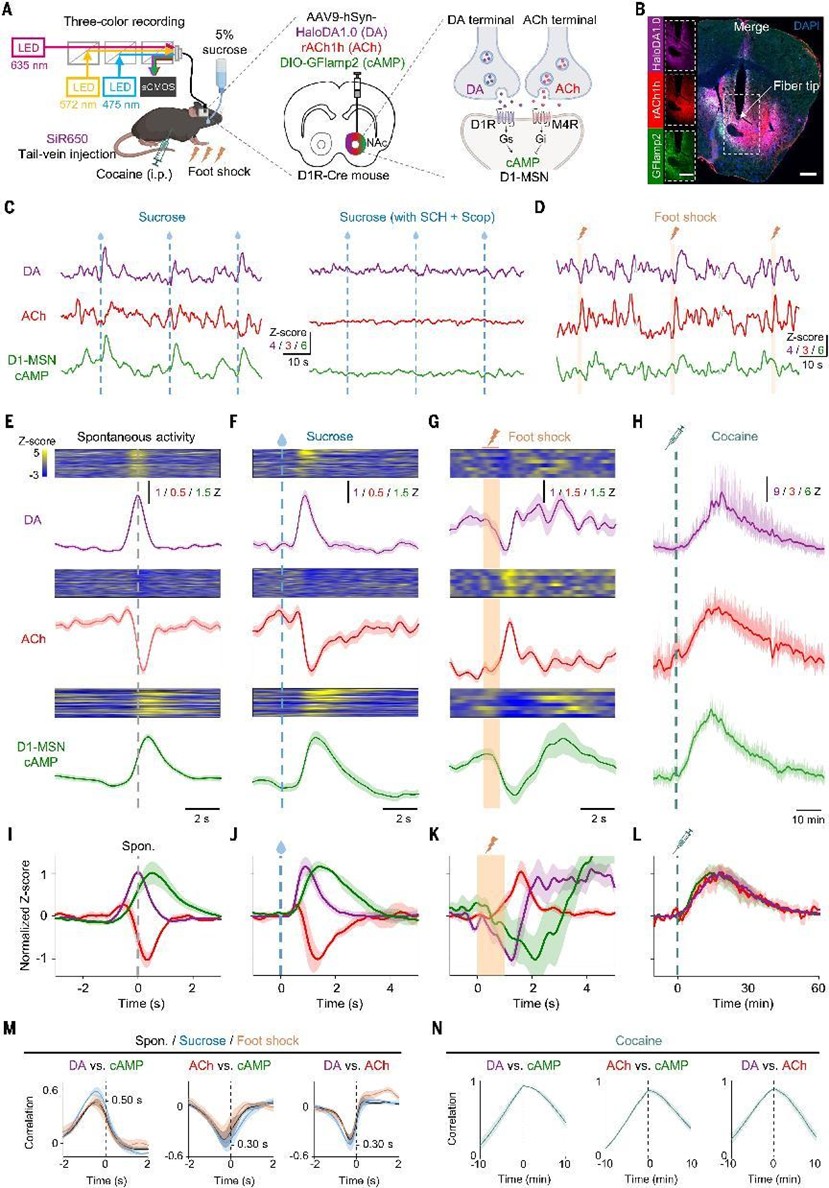
图5 小鼠体内DA、Ach和cAMP的同步动态监测
总结与展望
综上所述,这项研究开发了可用于体内成像的远红色DA传感器HaloDA1.0,其具有高灵敏度、高响应、低干扰等优点,且兼容绿色与红色通道,适合多模态神经递质共成像,广泛适用于细胞、脑片、斑马鱼、小鼠等系统,显示出极高的拓展潜力与工具价值。尽管目前仍存在染料稳定性、组织渗透性与多通道扩展性等挑战,但HaloDA1.0展示出化学遗传策略在GPCR类传感器开发中的前沿优势,未来可结合SNAP、CLIP等正交标签,实现更多神经调质的同步监测。









