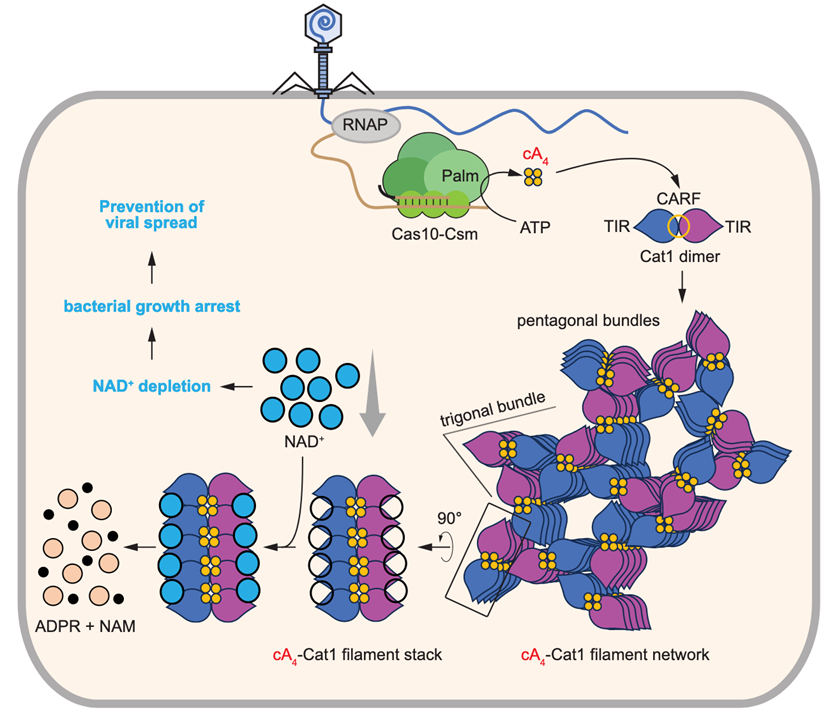
CRISPR-Cas系统通过RNA引导复合物保护细菌和古菌免受病毒(噬菌体)感染,根据其免疫分子机制可分为不同类型。III型CRISPR-Cas 系统编码以Cas10为主要亚基的效应复合物,Cas10复合物识别互补噬菌体转录本后,激活环化酶合成环寡腺苷酸(cOAs),作为第二信使激活CRISPR相关Rossmann折叠(CARF)效应因子。该类效应因子含CARF结构域(二聚化形成cOA结合位点)和酶活性附加结构域,通过DNA/RNA切割、膜去极化、ATP脱氨等方式干扰噬菌体感染周期,但会导致宿主细胞受损,因此通过群体水平免疫实现防御。目前Ⅲ型系统关联的CARF效应因子多样,但多数功能尚未明确。

1
Cat1在cA4存在下降解NAD+导致生长停滞
为发现新型CARF效应因子,研究利用Foldseek和PSI-BLAST,从Chloroflexota细菌中鉴定到含TIR-CARF结构域的蛋白chCat1及其同源蛋白。在携带Ⅲ-A型CRISPR-Cas系统的葡萄球菌中验证发现部分Cat1同源蛋白可被系统产生的cOAs激活并导致宿主生长延迟,其中MCI0612855.1(此后称该同源蛋白为Cat1)毒性最为显著(图1A)。
进一步研究发现Cat1的活性依赖于有靶向crRNA和Cas10环化酶的活性(产生cOAs)(图1B)。在CRISPR系统激活后,Cat1并不会直接引起细胞死亡,因为在移除诱导剂后,细菌能够恢复生长,表明其导致的是可逆性生长抑制(图1C)。显微观察也显示细菌未发生裂解,但增殖能力受限。
TIR结构域被证明参与NAD⁺降解的研究,研究人员假设Cat1可能通过类似机制介导毒性。实验结果显示,CRISPR系统激活后,表达Cat1的细胞中NAD⁺/NADH总量(NAD(H))显著下降,而缺乏Cat1或crRNA的对照则未见该现象(图1E)。体外实验进一步证实,Cat1在cA4(cOA一员)存在时能催化NAD⁺分解为烟酰胺(NAM)和腺苷二磷酸核糖(ADPR),该反应不依赖金属离子,且Cat1本身不降解cA4,说明其不是cOA降解酶(图1F)。整体结果表明,Cat1是一种cA4激活的NAD⁺水解酶,参与CRISPR介导的抗病毒免疫反应,通过消耗NAD⁺使细菌暂时性休眠,从而阻止噬菌体扩增。
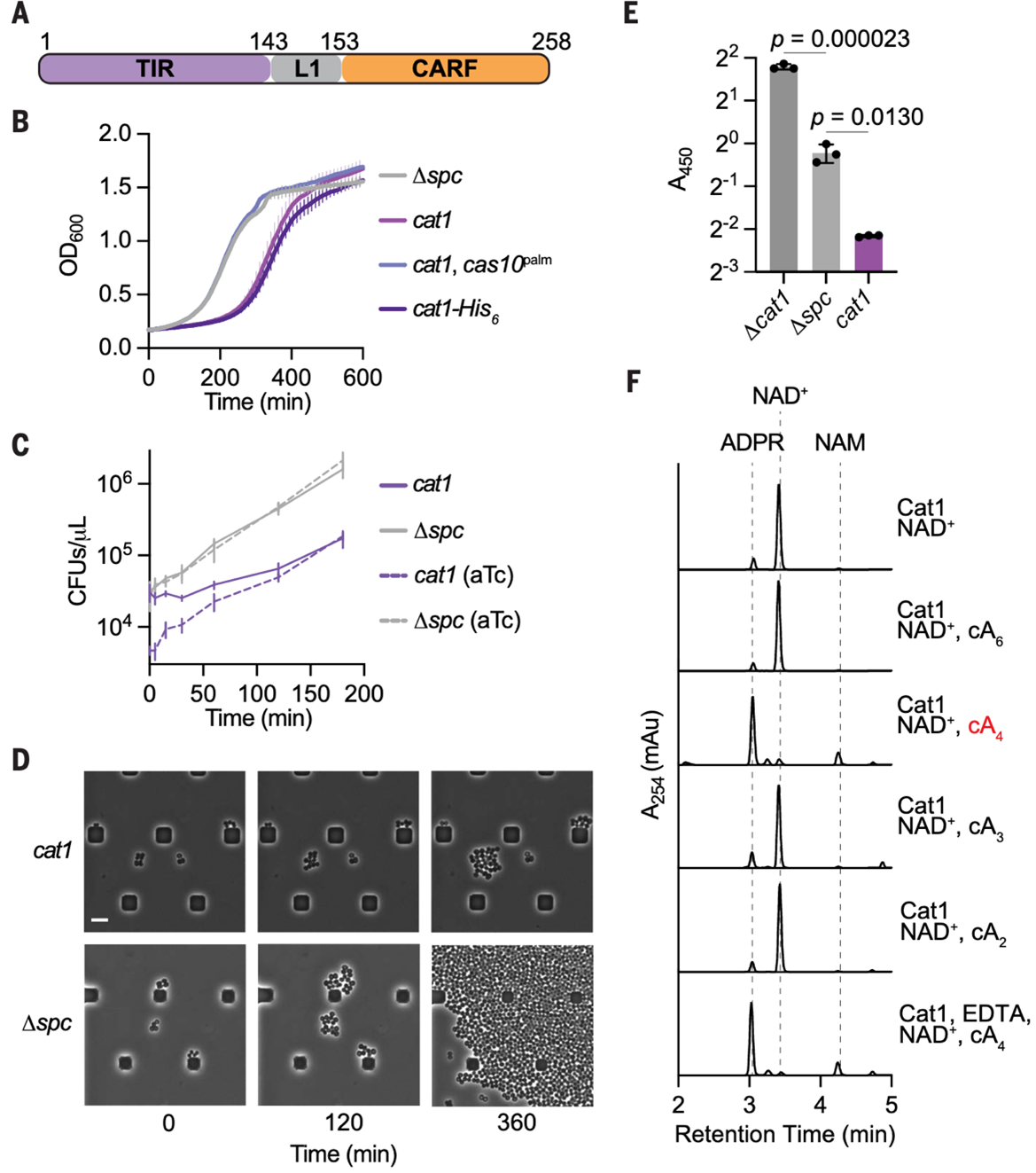
图1. Cat1介导的NAD⁺耗竭导致生长停滞
2
Cat1在结合cA4后组装成丝状结构
为了从原子层面理解Cat1的活性,研究人员开展了结构研究在缺乏cA4配体时,多角度光散射尺寸排阻色谱(SEC-MALS)显示Cat1形成二聚体(57 kDa±7%)(图2A),而当与cA4孵育后,溶液出现明显浑浊,提示其形成高阶蛋白组装体。冷冻电镜结构显示,该结构是由TIR-CARF二聚体沿轴向重复堆叠形成的,其中CARF结构域居中、TIR结构域向外延伸,相邻TIR-CARF二聚体通过夹在中间的cA4配体锚定并连续堆叠,形成略带扭曲的线性长丝(图2B和2C)。与其他CARF效应因子不同,Cat1的cA4结合口袋由两个CARF二聚体构成——底部二聚体形成口袋基座,顶部二聚体覆盖配体,其中底部CARF结构域的 W215、N234、S235 和顶部的K225、N226、R227为关键互作位点(图2D)。突变实验表明,W215A、S235A及顶部三个位点突变(K225A、N226A、R227A)均会破坏Cat1在Ⅲ-A型CRISPR-Cas反应中介导的生长停滞(图2E,F),双位点突变(如 K225A/S235A、R227A/W215A)则干扰丝状物形成和CARF结构域二聚化。这些结果证实,cA4配体与长丝两侧CARF二聚体的关键互作驱动了Cat1的丝状物组装,揭示了cA4作为 “分子胶水” 介导CARF效应因子长丝形成的独特结构机制。 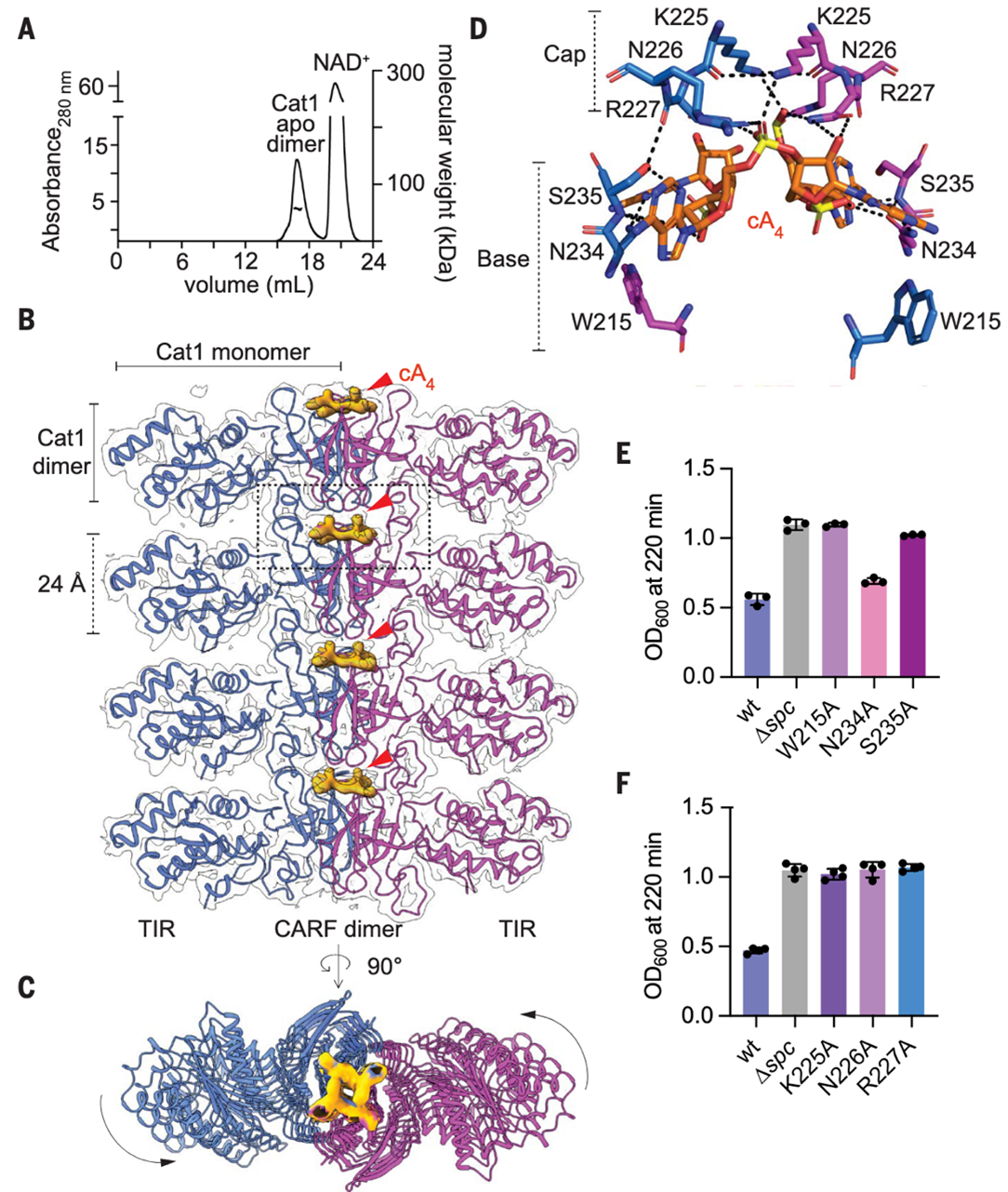
图2. cA4 结合驱动Cat1丝状组装
3
Cat1丝状网络结构增强其NAD⁺水解活性
进一步研究发现,Cat1在结合cA4后形成的丝状结构不仅限于简单的线性聚合,还会构建成更复杂的高阶螺旋网络。三对Cat1二聚体可组成三角状聚集体(trigonal assembly)(图3A),进而通过重复堆叠形成螺旋状丝束(spiral filament bundle)(图3B),并进一步聚合成包含五个三角单元的五聚体网络(pentameric assembly),中间形成大的中空孔道(图3C,D)。该过程依赖于两个关键区域的主链间氢键:CARF结构域的β1β2环(N158–G159)与邻近TIR结构域中的N103–A104。
分别删除上述关键残基,发现这些突变体仍能折叠,但失去了形成完整丝状结构的能力(仅残留短片段),并在CRISPR系统激活时不再导致NAD⁺耗竭或细胞生长抑制(图3E,F)。体外活性测定也显示这两个突变显著降低了Cat1的NAD⁺水解效率(图3G)。此外,通过不同浓度的Cat1测试发现其NAD⁺降解速率呈S型曲线,Hill系数接近5,表明Cat1活性具有明显的正协同性,即需要达到一定蛋白浓度才能高效催化(图3H)。这说明高阶聚合是实现其最大催化活性的关键。最后,研究还显示Cat1丝状聚合物在细胞中并非稳定不变。当停止cA4信号后,Cat1丝状结构会逐渐解聚,NAD⁺水平随之恢复。这表明Cat1活性不仅由结构驱动,而且是动态可逆的。
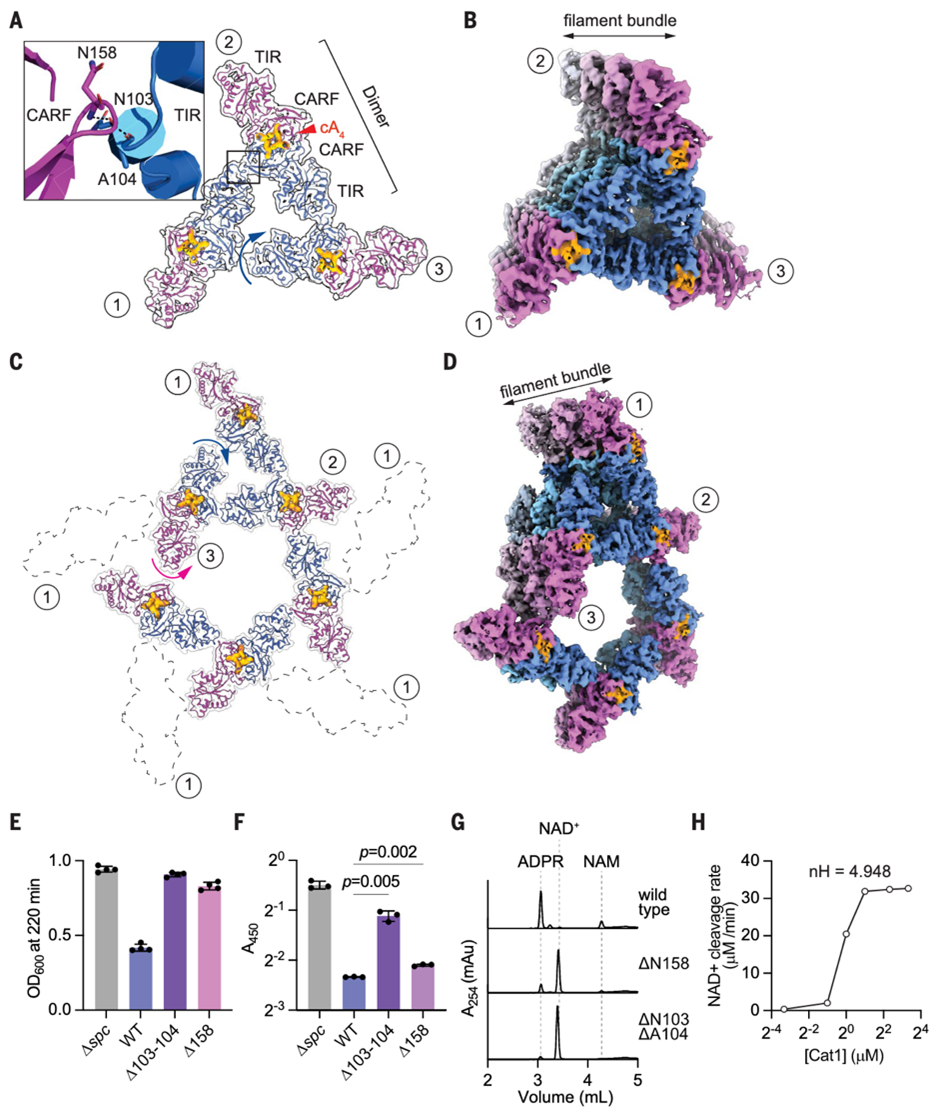
图3. 高阶丝状网络结构增强Cat1的NAD⁺降解活性
4
丝状聚合是Cat1活性位点形成的必要条件
为在原子水平上理解Cat1丝状聚合对其催化NAD⁺裂解的影响,研究人员解析了结合cA4与NAD⁺(4 Å)或其不可水解的NAD⁺类似物BAD(benzamide adenine dinucleotide)(3.3Å)的冷冻电镜结构。在结构中,每个模型包括两个堆叠的Cat1二聚体,显示出其活性位点由两个不同Cat1二聚体中的TIR结构域共同构成,特别是BB环区域调控底物进入催化位点(图4A,B)。活性位点由多个关键残基(如D33、Y122等)共同构成(图C,D)。突变这些残基(如D33A、Y122A)会显著降低或完全丧失Cat1的毒性与催化活性,特别是Y122A突变可完全阻断NAD⁺降解(图4E-G)。尽管部分突变(如D33A)在体外仍具一定活性,但在体内不再引发毒性,说明细胞能耐受轻度NAD⁺下降。
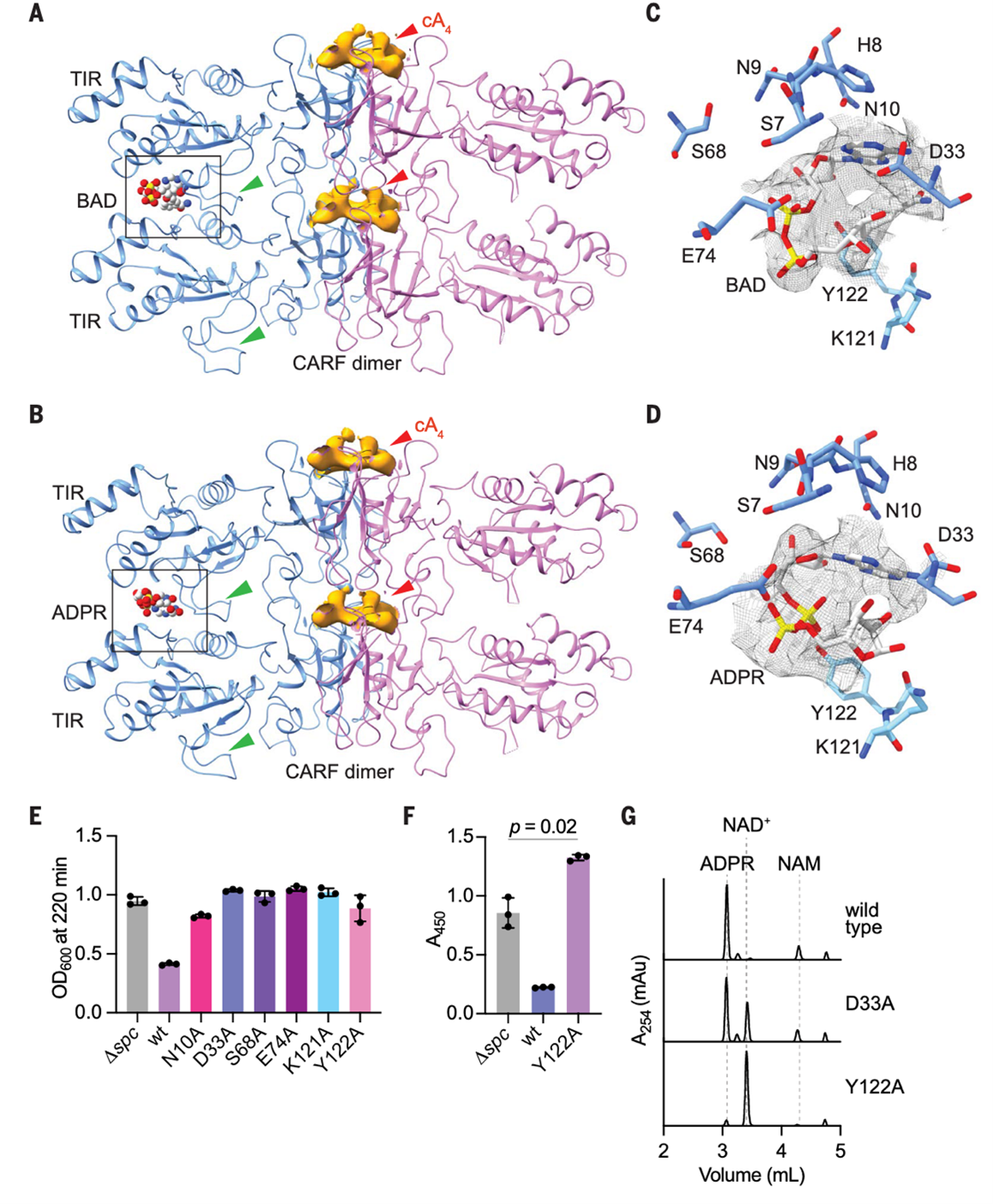
图4. 丝状聚合是Cat1活性位点形成的必要条件
5
Cat1 赋予抗噬菌体免疫功能
大多数已知的CARF效应蛋白,其毒性作用在Cas10核酸酶活性缺失时是抗噬菌体免疫所必需的。Cas10核酸酶失活的情况下(cas10HD),Cat1仍能通过靶向噬菌体早晚期转录本的间隔序列(如spc14和spc43)显著降低噬菌斑形成单位(PFUs),防止低感染复数下液体培养物崩溃(图 5A-D)。荧光显微观察显示,Cat1激活导致感染细胞(GFP 标记)生长停滞而未感染细胞继续分裂(图 5E),部分感染细胞裂解,印证了CARF效应因子通过群体免疫抑制病毒传播的机制。进一步研究表明,Cat1对多种葡萄球菌噬菌体具有广谱防御作用,可将病毒繁殖量降低约两个数量级并支持宿主菌存活,体现了原核生物通过代谢调控实现 “群体免疫” 的独特抗病毒策略。
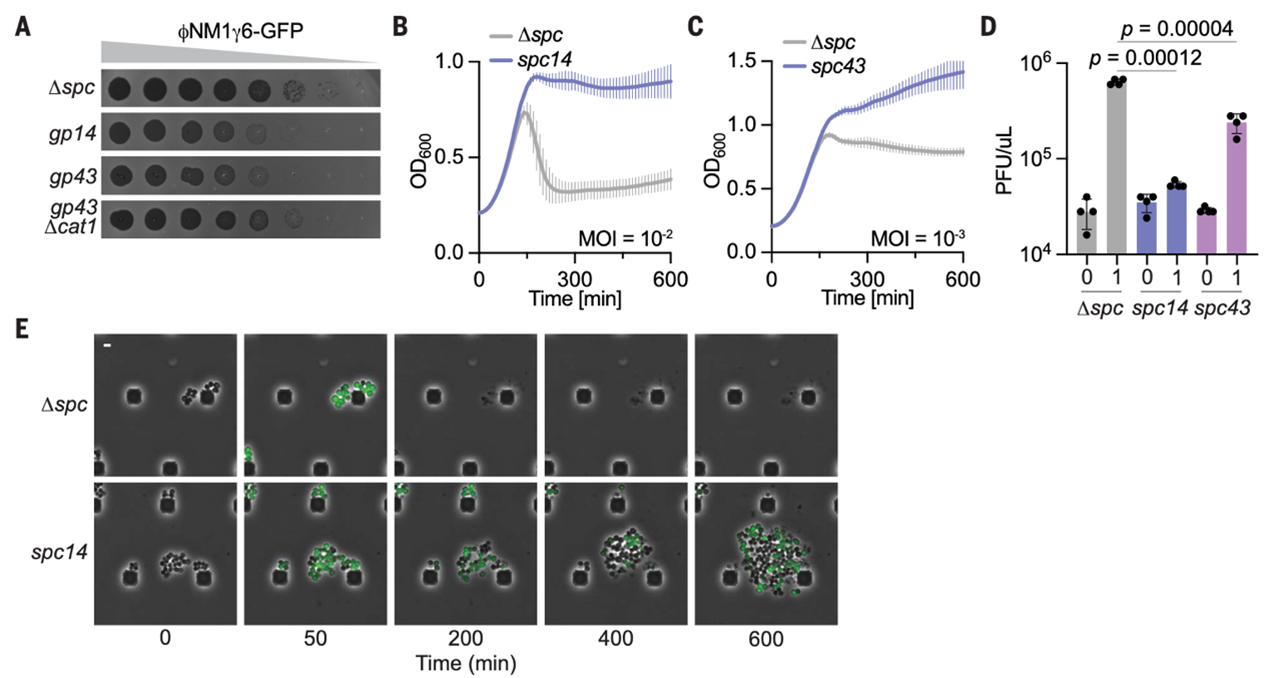
图5. Cat1介导抗病毒免疫
6
总结
本篇研究揭示了Ⅲ型CRISPR相关CARF效应因子Cat1的功能与结构。当RNA引导的 Cas10复合物识别病毒靶转录本后合成cA4,Cat1与cA4结合并形成长丝结构,进而组装成高阶复合体。这种丝状组装不仅为Cat1的底物NAD+创造了结合口袋,还能激活 NAD+降解活性。因此,Cat1的激活会导致宿主细胞内NAD+耗竭,使其进入无法支持病毒复制的生长停滞状态(图 6)。