电压激活的钠(Nav)和钾(Kv)通道的开放会产生动作电位,这些通道能快速失活,从而塑造神经冲动,并有助于突触易化和短期记忆。关于快速失活的机制存在争议,此前有两种观点:一是涉及一个细胞内结构域阻断Nav和Kv通道的内部孔道;二是认为内部孔道在失活过程中关闭。果蝇Shaker Kv通道等的N型失活被认为与N端阻断孔道相关,且受多种因素调控,对电信号传导至关重要,但相关结构基础尚未明确。
来自美国美国国立卫生研究院的Kenton J. Swartz研究团队采用了冷冻电子显微镜、质谱和电生理学方法,对Shaker Kv通道的快速失活机制进行研究。

研究人员先尝试解析野生型(WT)Shaker Kv 通道的结构,在利于失活的离子条件下用冷冻电镜观察,虽获得一定分辨率结构,但因N端可能发生蛋白水解,未明确观察到N端在内部孔道的密度(图1a-d)。为减少N端水解,构建了N端带标签、切割后残留 Gly和Thr(GT Shaker)的构建体,经电生理实验验证,额外残基不会干扰失活(图1a, e, f),但可能使失活状态不稳定(图1g, h),而未切割的bulky标签会破坏N型失活(图1e)。
为捕捉GT Shaker的失活状态,研究人员将该蛋白重组到纳米盘中。对GT Shaker的冷冻电镜分析得到三类结构(A-C),均为电压感应域激活、内部门开放状态。其中A类(2.94 Å)被认定为完全失活状态,N端非极性区域以延伸构象完全堵塞内部孔道(图 1i),与早期研究结论一致;B类结构额外密度位于孔道的内部末端(图1j);C类结构额外密度开始进入内部孔道(图1k)。研究人员推测B、C 类可能为失活中间态或源于N端水解的四聚体。
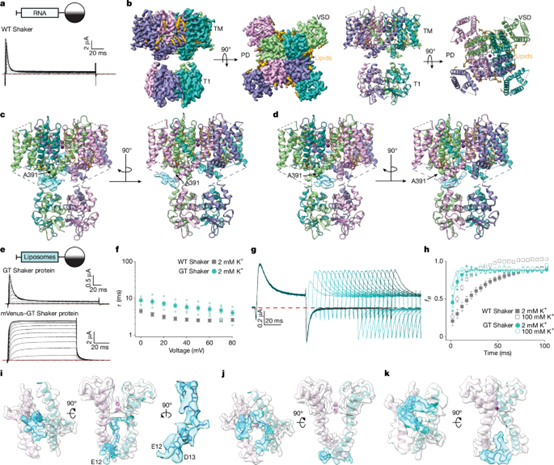
图1. 修饰后的Shaker Kv通道结构
为提高获得 N 型失活状态高分辨率结构的概率,研究者在Shaker通道中引入 E12K和D13K突变(AcA-EI Shaker)以加快N端与孔道结合,从而更易捕捉N型失活态。该构建体N端甲硫氨酸被切除、2位丙氨酸乙酰化,电生理显示其失活更快。冷冻电镜解析得到三类构象:
A类:额外密度在跨膜域与T1域间腔室内(类似GT Shaker的B类,图2a-c)。
B类:一段密度深入孔道,另一段靠近腔室的侧向入口(图2d-f)。
C类:密度延伸并持续堵塞孔道(类似GT Shaker的A类,完全失活态,图2g-i)。
结构显示N端在失活态中与内部孔道中一个特别关键的位点 I470 结合或邻近,而 RNA编辑正是通过调控该位点来调节快速失活(图2a,d,g),并通过L7与V478、P475构成疏水三联体稳定失活(图3b、e、h),Y8(该位点的突变会破坏失活状态的稳定性)靠近N482(图2c,i),E12K/D13K带电残基位于孔外腔室,通过长程静电作用加快结合速率,不改变失活状态稳定性。
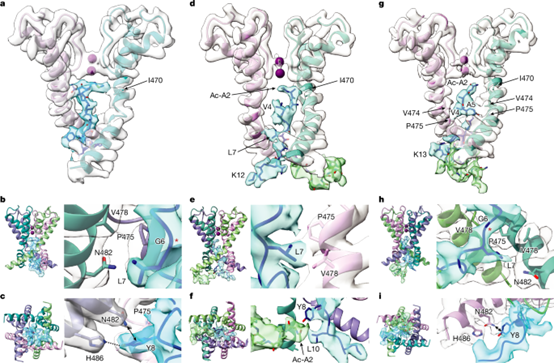
图2. Shaker Kv 通道 N 型失活状态的结构
以往研究认为Shaker通道的N型失活是由N端肽段堵塞孔道造成的,但结构显示进入孔道的部分为非极性且已乙酰化,不带有可参与静电排斥的电荷,因此外部K⁺和膜电压加快恢复并非通过类似阳离子毒素的静电排斥机制。研究人员推测N型失活会减少选择性过滤器接触内部K⁺,从而促进缓慢的C型失活;而C型失活又可能稳定N型失活。提高外部K⁺浓度或施加负电压可以增加过滤器的K⁺占有率,使其从C型失活转回到传导状态,从而加快N型失活的恢复。
为验证这一可能性,研究人员在低和高外部 K⁺条件下测量了从N型失活中的恢复情况(图3)。实验表明,在低外部K⁺条件下恢复更慢,高外部K⁺可逆转这一效果(图3c,d);稳定传导状态的T449V 突变通道恢复更快、对外部K⁺不敏感(图3a,b,c,e),说明C型失活确实会稳定N型失活,但外部K⁺加快恢复可能还存在其他机制。
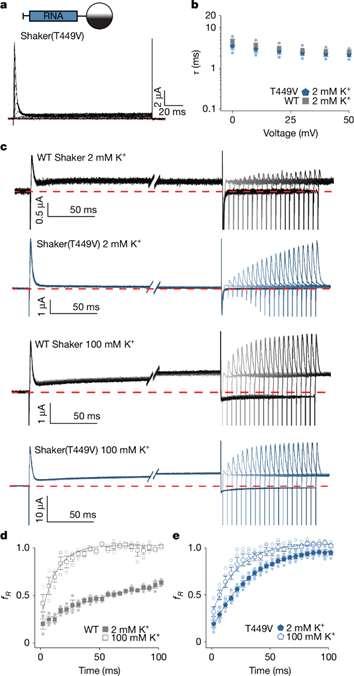
图3. 慢C型失活调控N型失活的恢复
冷冻电镜结构显示,Shaker 通道的N端以延伸构象插入内侧孔道,与早期研究结论及相关实验结果相符,如乙酰化丙氨酸与I470形成关键疏水相互作用,可以解释RNA编辑使I470 变为Val后对失活的影响,V4、A5与S6残基的相互作用也得到功能研究支持(图2g)。为验证结构,研究人员通过突变研究了两个关键区域:
一是S6螺旋中Y8与N482的相互作用,N482的侧链指向孔道最内侧、靠近Y8的N端失活颗粒(图2c,f)。通过N482A/ N482L/ N482W突变引入更大疏水侧链,会减慢失活恢复(图4a–h),推测其通过与N端疏水残基作用稳定失活状态,而N480突变影响小;
二是S6中P475、V478形成的疏水三联体的作用,V478突变后失活起始减慢、程度降低、恢复加快(图4i–l),表明L7与V478等形成的疏水三联体对稳定N型失活状态至关重要。
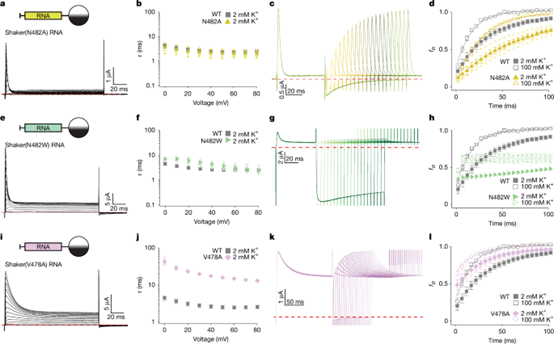
图4. 探究Shaker Kv通道N端堵塞结构域的关键相互作用
最后,总结研究主要发现有以下几点:
1.研究解析出完全失活状态的结构,其中N端的非极性末端以延伸构象堵塞内部孔道。N端的甲硫氨酸被删除,留下一个被乙酰化的丙氨酸,它与一个孔内衬异亮氨酸残基相互作用,而RNA编辑会调节该位置的快速失活。
2.研究发现内部激活门的开放是快速失活所必需的,因为它使plug结构域能够阻断孔道,并重新定位门残基以与该结构域相互作用并稳定它。
3.此外,研究还探究了外部 K⁺通过改变离子选择性过滤器的构象而非静电排斥来破坏失活状态的稳定性。
这些发现确立了Kv通道中快速失活的机制,揭示了它如何受RNA编辑和N端乙酰化的调节,并为理解其他电压激活通道中的相关机制提供了框架。









