蛋白质质量控制(PQC)依赖泛素–蛋白酶体系统清除错误折叠或错误定位的蛋白质,其异常与多种疾病密切相关。UBR4是一种高度保守且必需的E3/E4连接酶,在神经元和肌肉等高代谢细胞中维持蛋白稳态。它能够识别多种应激信号,并通过连接蛋白酶体和自噬途径实现异常蛋白的高效清除。UBR4 的活性还与两种特定辅因子相关:钙结合蛋白钙调蛋白1(CALM1)和钾通道调节因子1(KCMF1),但二者如何共同调控其底物选择性和链延伸活性仍不清楚。
来自奥地利维也纳生物中心(VBC)分子病理学研究所的Tim Clausen团队通过重建人、线虫和植物的UBR4复合物,解析其结构和功能,为理解UBR4在PQC与疾病中的核心作用提供了比较框架。

研究人员首先在昆虫细胞中共表达了UBR4、KCMF1和CALM1,纯化得到约1.5 MDa的三元复合物,对应二聚化的异源三聚体(图1) 。冷冻电镜结构解析显示,两个UBR4分子通过两个不同的Arm重复区域界面形成环状装配体,C端界面结合CALM1和KCMF1。其中,KCMF1的螺旋“插销”结构稳定UBR4构象,突变该螺旋导致UBR4仅以单体存在;CALM1稳定结合UBR4疏水螺旋,其结合不受钙螯合剂影响(图1)。环状骨架内外分布有多个柔性附属结构,包括由UBR box、β propeller和β sandwich 1组成的内腔附属域,以及含锌指和β sandwich 2的C端附加域(图1)。此外,C端Arm重复延伸出UBL结构域和柔性连接的E4催化半RING模块(未解析)。整体结果揭示了UBR4与辅助因子协作形成环状泛素化平台。
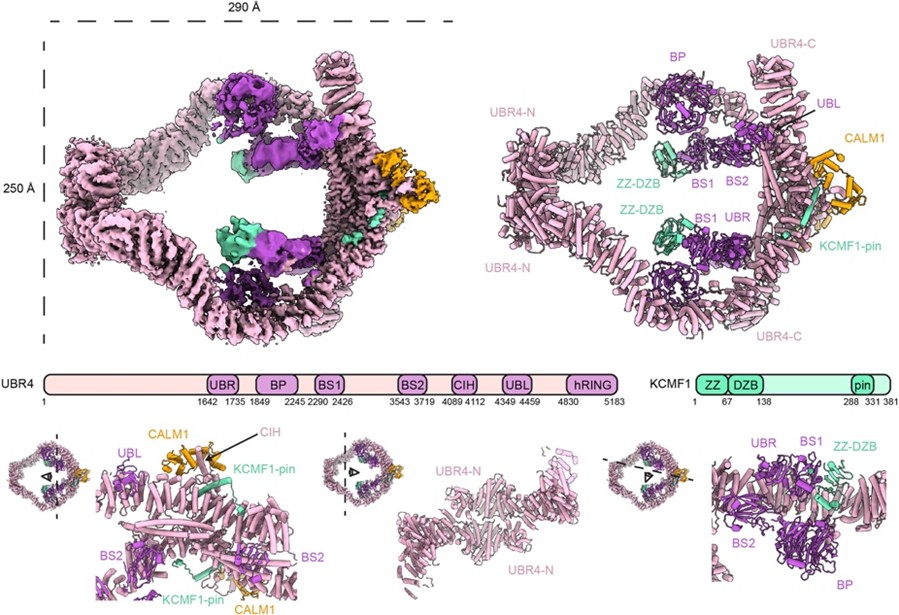
图1.人类UBR4复合物的结构
之后,研究人员建立了 Ub(泛素-ΔGG)与Ub-K0(无赖氨酸)体系来监测E4活性,结果显示UBR4仅能对已被E3泛素化的底物进行K48链延伸,且该活性依赖于 UBL结构域(图2A)。结构与功能分析表明,UBL与泛素结合并将其K48定位于E2~Ub硫酯键附近,从而在半RING模块的协同下特异性促进K48链延伸。冷冻电镜解析显示,UBE2A通过背面结合模式固定在UBR4 C端延伸区,同时被定位在UBL邻近的狭窄腔口处,有利于供体和受体泛素的精准对接(图2B)。进一步建模揭示,UBL结合的受体Ub与E2携带的供体Ub几何排列合理,使K48残基正对转移位点(图2C)。功能验证表明,UBL突变(UBL-3A)、半RING缺失(ΔRING)或E2背面结合界面突变(E2B-5A)均完全消除E4活性(图2D)。UBR4通过UBL–Ub结合与E2定位的协同作用,在其环状腔体中实现K48特异性链延伸,提示底物识别位点应位于环的中央腔体(图2E)。
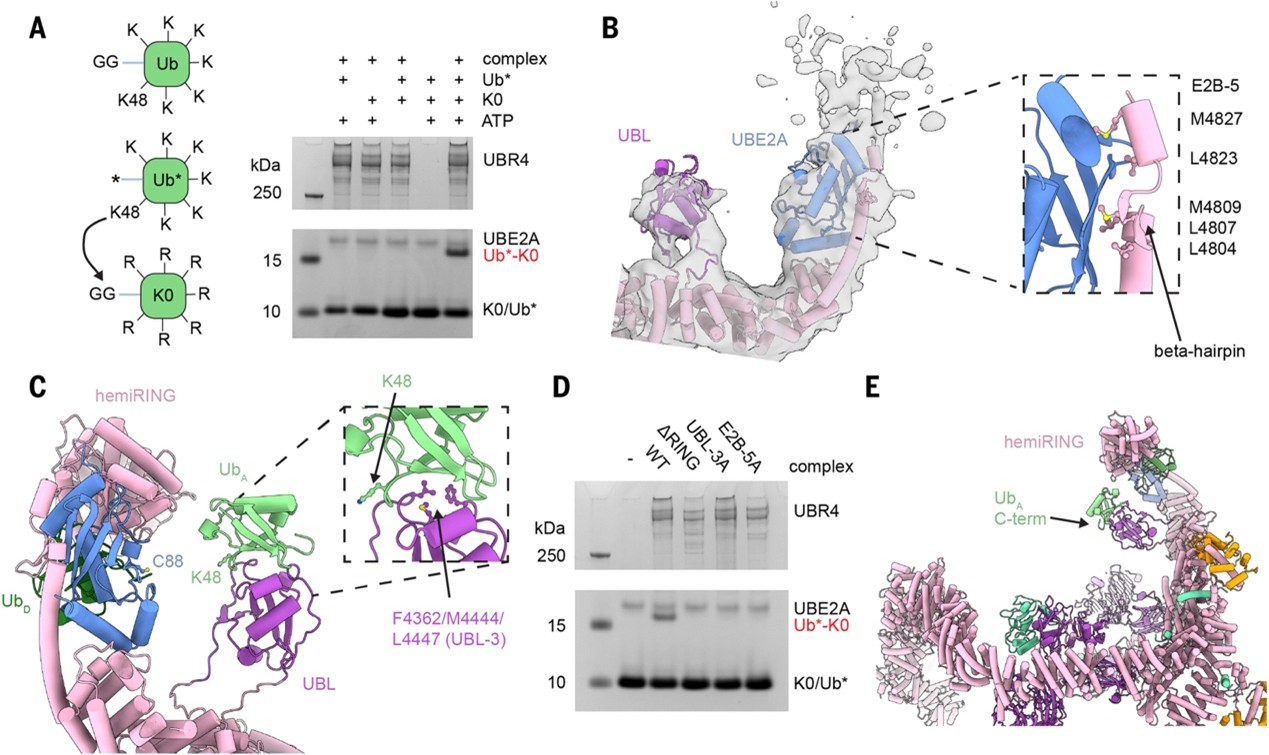
图2.UBR4复合物延伸泛素链的机制
UBR4复合物拥有巨大的底物结合腔体和灵活的E4臂。冷冻电镜显示,腔体内存在额外密度(图3A),研究人员推测是由KCMF1的ZZ-DZB结构域介导结合的底物。缺失ZZ-DZB后,该密度和相关底物均消失,说明ZZ-DZB是主要底物受体(图3A)。质谱结果表明,线粒体蛋白(如SSBP1、NDUFA5、MRPS17等)在野生型UBR4中富集,提示其参与线粒体质量控制(图3B)。体外泛素化实验表明,UBR4 不能启动泛素化,而是在已有Ub标记的底物上进行K48链延伸,表现为典型E4活性(图 3C)。相比之下,HUWE1可作为E3起始酶为UBR4提供延伸底物,而KCMF1缺乏E3功能(图3D)。进一步实验发现,带有线粒体靶向序列(MTS)或特定N端(如NRT/NST)的底物更易被识别和修饰(图3E-G)。这些数据表明ZZ-DZB是UBR4复合物的主要底物受体,而E4结合区域中的其他结构域可能对底物特异性起到精细调控作用。
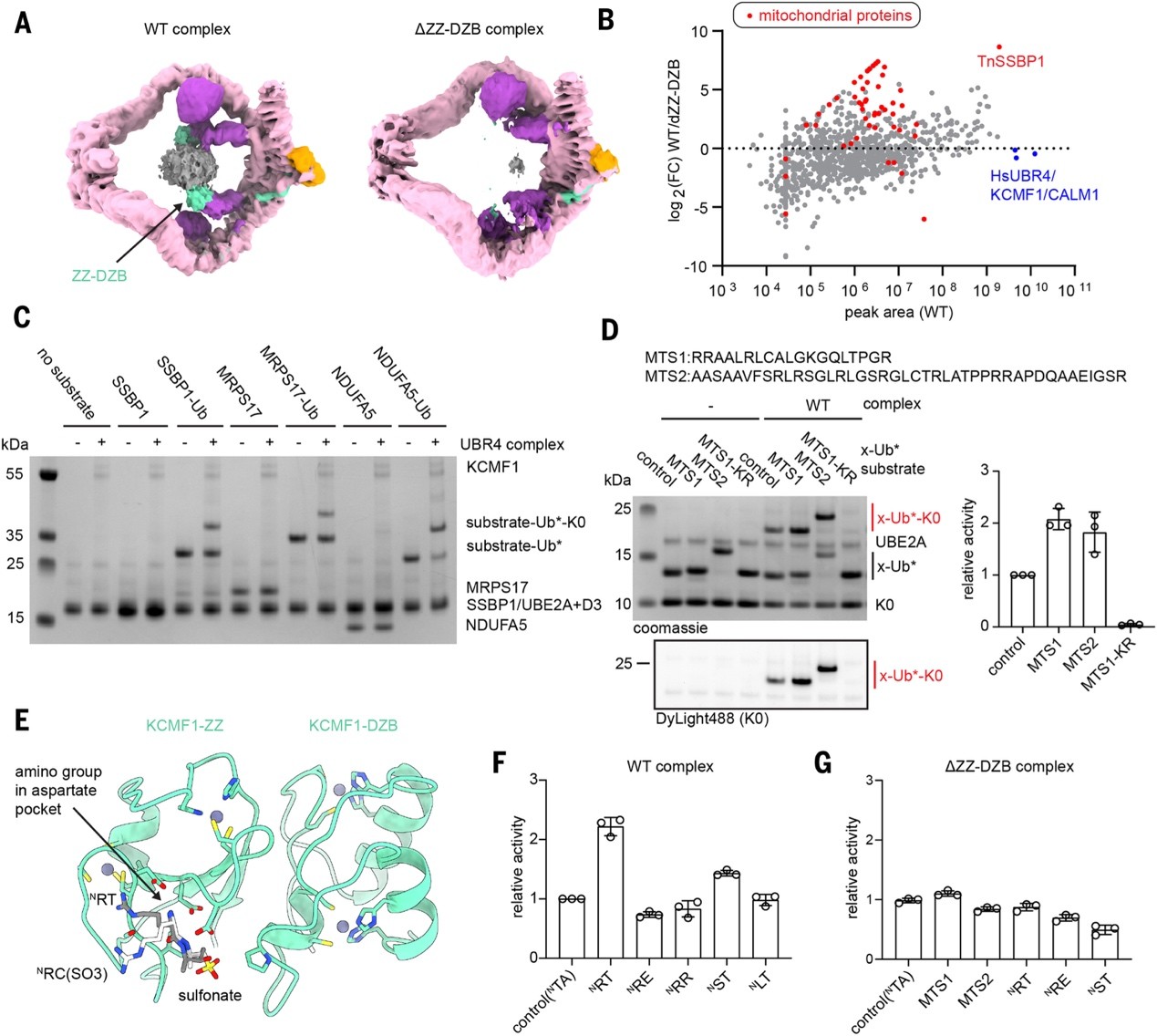
图3. KCMF1介导UBR4底物的选择
UBR4 在多种真核生物中发挥蛋白质质量控制作用,但其与KCMF1 和CALM1的协作在动物之外尚未被证实。研究人员重建了秀丽线虫UBR4复合物,发现其保持环状结构,但二聚化界面和拓扑结构与人源不同(图4A),且不依赖CALM1,而由 CeKCMF1 插入结构维持稳定(图4B)。质谱和冷冻电镜结果表明,线虫UBR4更倾向识别孤立的线粒体酰基辅酶A脱氢酶(ACADM)亚基,并通过特有的疏水螺旋辅助底物结合(图4C)。随后研究人员还研究了拟南芥UBR4(BIG),并鉴定出 DI19 作为 KCMF1 的植物同源物。AtUBR4–DI19–CALM1 复合物在结构上与人源类似(图4D) ,但植物中ZZ结构域位于UBR4本体而非辅因子。晶体结构显示,AtUBR4-ZZ对NRA/NRR序列有结合活性,区别于人源 KCMF1-ZZ 的偏好(图4E),提示其可作为传统的N-degron受体。总体上,UBR4在不同物种中保留核心架构,但在辅因子利用和底物识别特性上发生了进化适应。
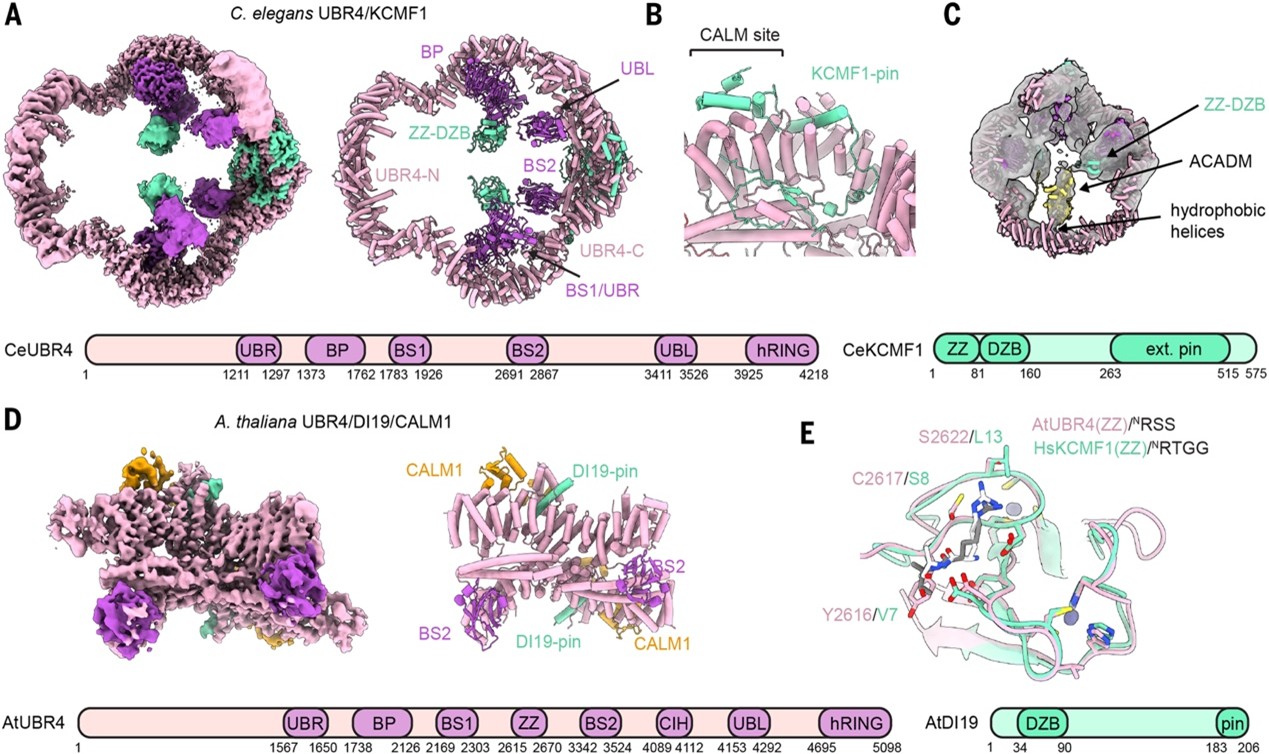
图4. UBR4复合体的进化保守性
真核生物的蛋白质稳态在一定程度上通过将泛素蛋白依次连接到靶蛋白上来维持。本篇文章解析了UBR4与其辅因子KCMF1和CALM1形成的大型环状结构,其具有中央底物结合区和灵活连接的催化单元。高效的底物靶向既依赖于底物的预泛素化修饰,也依赖特定的N-degron,而KCMF1在此过程中充当关键的底物过滤器。这种E4超大复合物的结构在真核生物中具有进化保守性,但物种特异性的适应性修饰,使UBR4能在不同的细胞环境中执行其精确调控的质量控制功能。









