Retrons是原核生物广泛存在的遗传元件,可通过逆转录特异性ncRNA生成msDNA,并与效应蛋白共同参与抗噬菌体防御。典型retron编码逆转录酶和结构化ncRNA,生成的msDNA与msrRNA形成DNA–RNA杂合物(图1A)。不同retron搭配多种效应蛋白,如NAD⁺水解酶或Septu系统中的PtuA(ATPase)和PtuB(内切酶),共同发挥防御作用(图1B,C)。Septu系统是最常见的抗噬菌体防御系统之一,但其激活机制此前未知。来自马萨诸塞大学医学院的傅天民团队解析了Retron–Septu的冷冻电镜结构,并发现其通过复合物解体介导的激活机制发挥功能。

研究人员首先通过表达Ec78-Septu与Ec83-Septu的全操纵子(包括ncRNA、RT、PtuA和PtuB基因)(图1B,C),纯化后发现它们均能形成含有RT、PtuA与PtuB的大分子复合物。进一步利用冷冻电镜解析了两种复合物的结构,分辨率分别为3.01 Å(Ec78-Septu)和 3.47 Å(Ec83-Septu)(图1D,E)。两个系统架构一致,均形成不对称核蛋白复合物,含1个RT、1个msDNA、2个PtuAB 亚复合物(PtuA:PtuB 均为 2:1,分别称PtuABI和PtuABII)(图1D-G)。空间排布上,Ec83-Septu的RT位于PtuABI 上方,借msdDNA与PtuABI紧密连接(图1F-H);Ec78-Septu的RT也在PtuABI顶部,但其msdDNA与PtuABII紧密结合(图1D)。最终,两系统的所有组分均形成发挥抗噬菌体防御功能的超分子复合物。
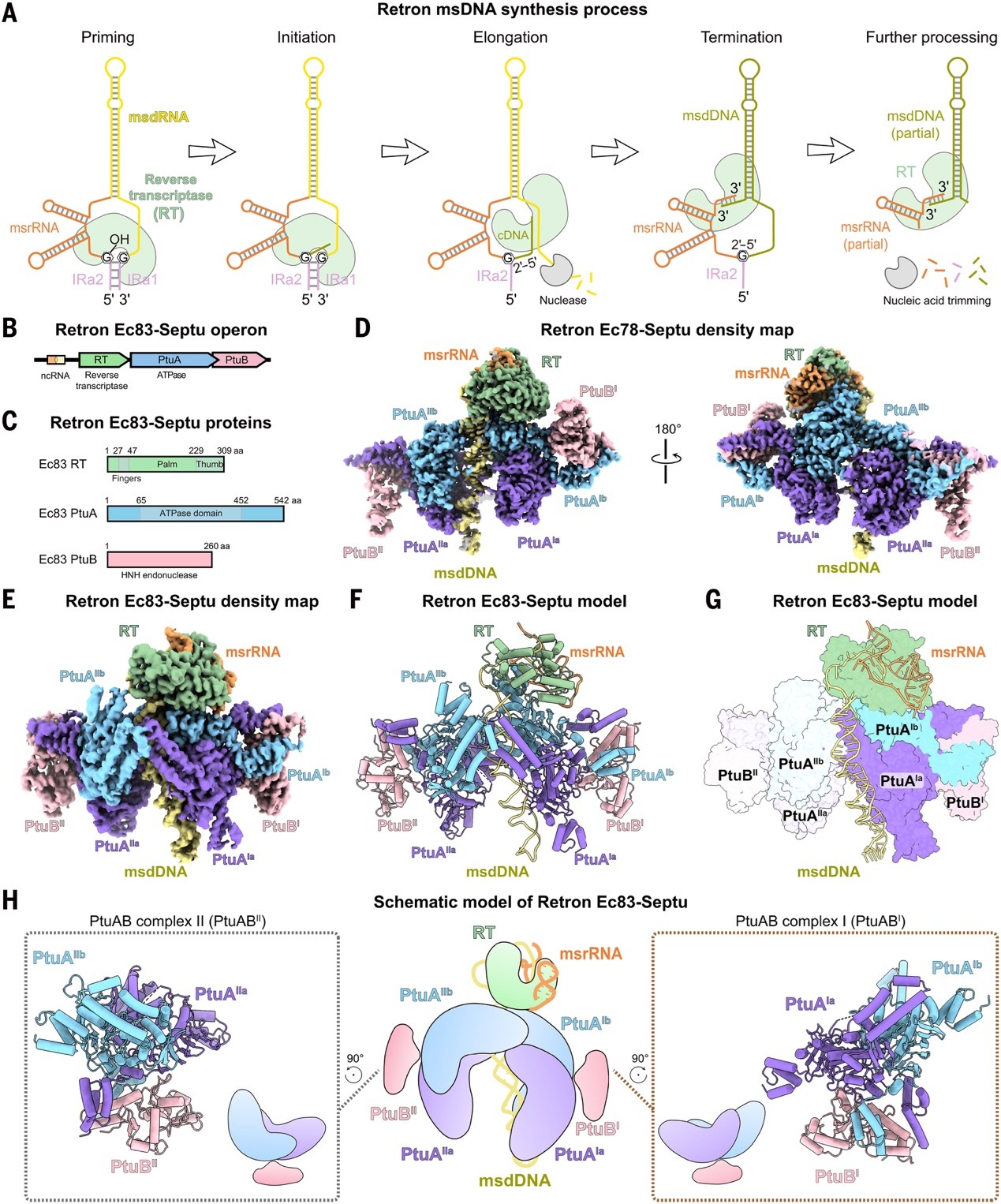
图1. Retron与Septu组装形成超分子复合物
此前认为Ec83的msDNA不含RNA,但本研究证实其同时含msrRNA与 msdDNA(2A-C),整体呈 “高尔夫球杆”状,其中msrRNA为“球杆头”、msdDNA为 “球杆杆身” (图2B)。仅部分片段可见且与Ec83的msDNA在部分区域存在结构差异;Ec83 RT呈 “右手折叠” 结构,由手指(fingers)、手掌(palm)和拇指(thumb)结构域组成,并形成一个协调核酸的中央裂隙(图2D-F)。其通过静电作用与msDNA结合, msrRNA嵌入RT 裂缝、msdDNA被RT的电正性区域固定,为RT结合Septu模块搭建结构平台(图2D);此外,msrRNA中高度保守的套索状RSLb-ssRb结构,会通过与RT相互作用及空间阻断(如阻断新核苷酸进入RT催化位点)终止逆转录(图2F-G),这一机制也为Retron 基基因组编辑工具的设计提供了参考。
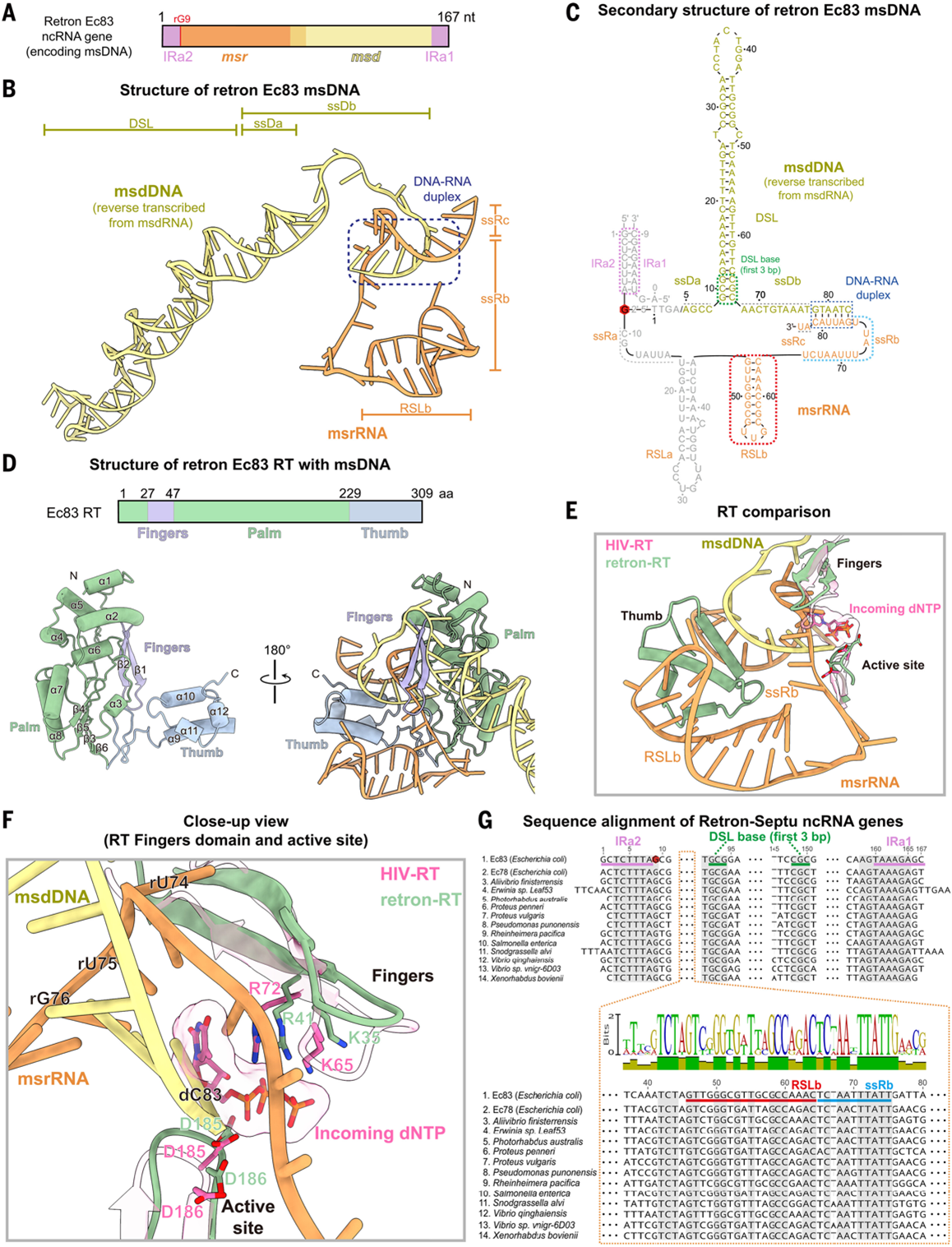
图2. msrRNA与msdDNA通过结合RT调控逆转录过程
结构分析显示,在Retron-Septu系统中,PtuA四聚体通过进化出的NTHB与 HHM 结构域形成中央孔道,不对称地结合msDNA与msrRNA(图1D–G,3A、B)。Dimer I 的两个原聚体与msdDNA骨架广泛相互作用,而Dimer II仅部分接触(图3A–F),其中PtuAIb还利用带正电残基稳定结合msdDNA和msrRNA(图3A),含K452/K454 的环作用于msrRNA(图 3F),PtuAIa靠静电作用结合msdDNA相关区域(图 3E)。整体上,关键残基突变会破坏这种核酸协调并导致抗噬菌体功能丧失(图3G),说明 PtuA 对msDNA/msrRNA的不对称调控对防御至关重要。
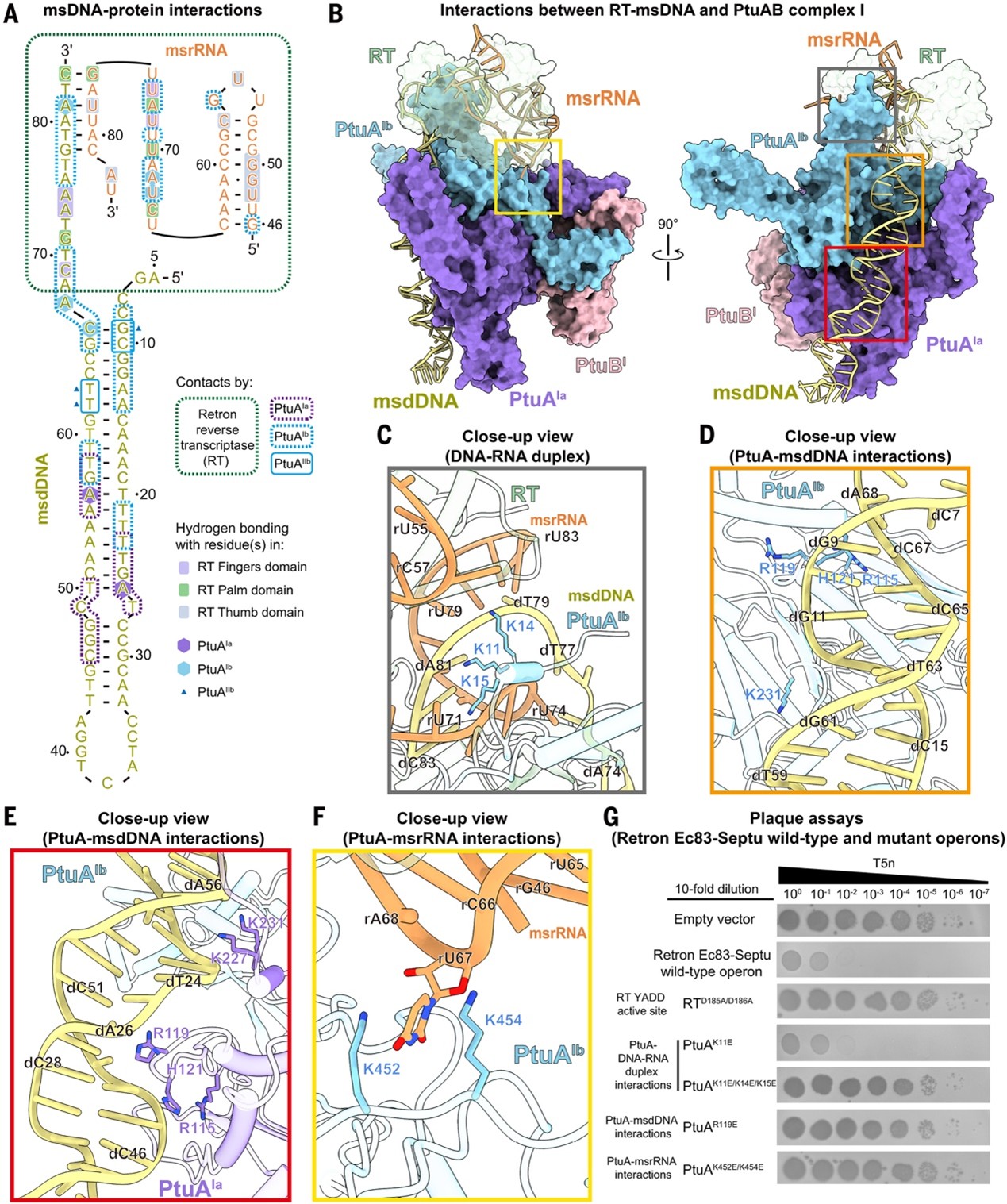
图3. PtuA 通过不对称结合msDNA稳定自抑制复合物
生物信息学分析显示,虽然Retron-Septu 系统中的RT较为保守,但PtuA和PtuB 序列多样且与RT共同进化,提示三者功能相关。核酸酶活性实验显示,完整的Retron-Septu复合物处于自抑制状态(图4A),但PtuAB二聚体具有强烈的核酸酶活性,能够特异性切割单链DNA(ssDNA),而不作用于双链DNA或RNA(图4B,C)。时间过程核酸酶实验表明,PtuA负责结合DNA并递交底物,PtuB则执行切割;ATP可通过抑制 PtuA的DNA结合降低其活性(图4E)。
在功能上,Retron Ec83-Septu能够阻断噬菌体T5的复制过程,依赖于PtuB的活性位点(图4F);突变PtuB的催化残基会完全丧失抗噬菌体能力(图4G)。此外,过量表达PtuAB在有抗生素筛选时会抑制宿主生长(图4H),推测其通过切割质粒ssDNA 干扰质粒复制,从而导致菌株失去抗性。
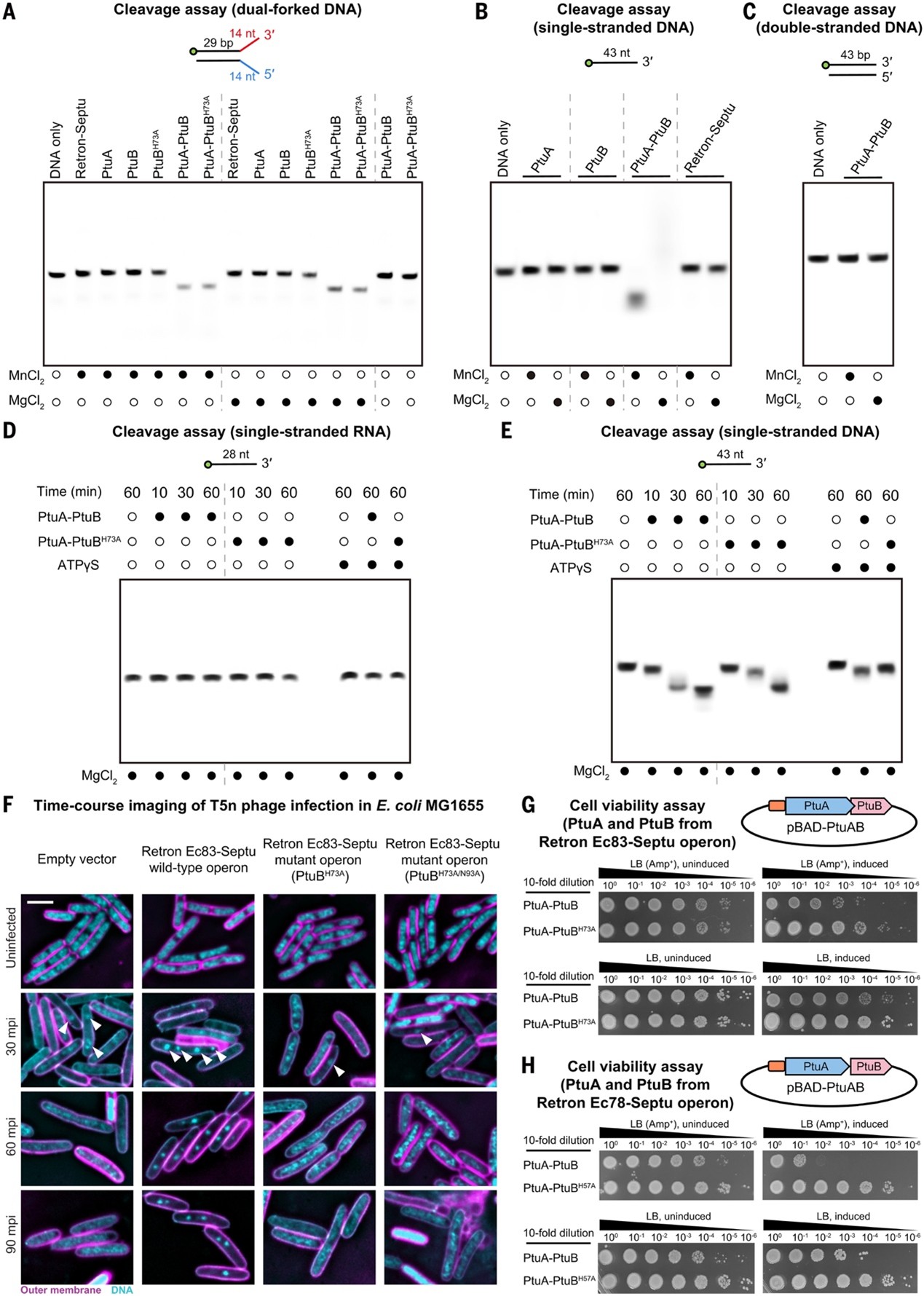
图4. Retrons Ec83-Septu 通过 PtuAB 介导的单链 DNA 切割抑制噬菌体复制
结构与生化分析显示,自抑制状态的该系统复合物可解离出活性PtuAB亚复合物(图 5A-F),研究人员推测msdDNA降解是PtuAB解离的关键触发步骤。通过突变 PtuA的Walker B基序和PtuB活性位点,成功解析突变型PtuAB结构(图5C),发现其 DNA结合区构象与解离状态的PtuAB、PtuA二聚体相似(图5D),提示DNA结合诱导构象重排,且完整复合物中PtuA含ADP,解离组件中含ATP(图5D),这些结果直接证明PtuA在完整的 retron Ec83-Septu 复合物中具有更高效的 ATP 水解能力。此外,二硫键交联的复合物因无法解离而丧失抗噬菌体活性,进一步证明解离是激活必需步骤(图5E)。
最后研究人员提出了这样一个模型:Retron-Septu系统通过“阻滞-释放”机制实现抗噬菌体防御(图 5F):静息时PtuAB 被滞留于自抑制超分子复合物中,噬菌体感染触发复合物解离,释放的PtuAB通过切割ssDNA发挥抗噬菌体作用。
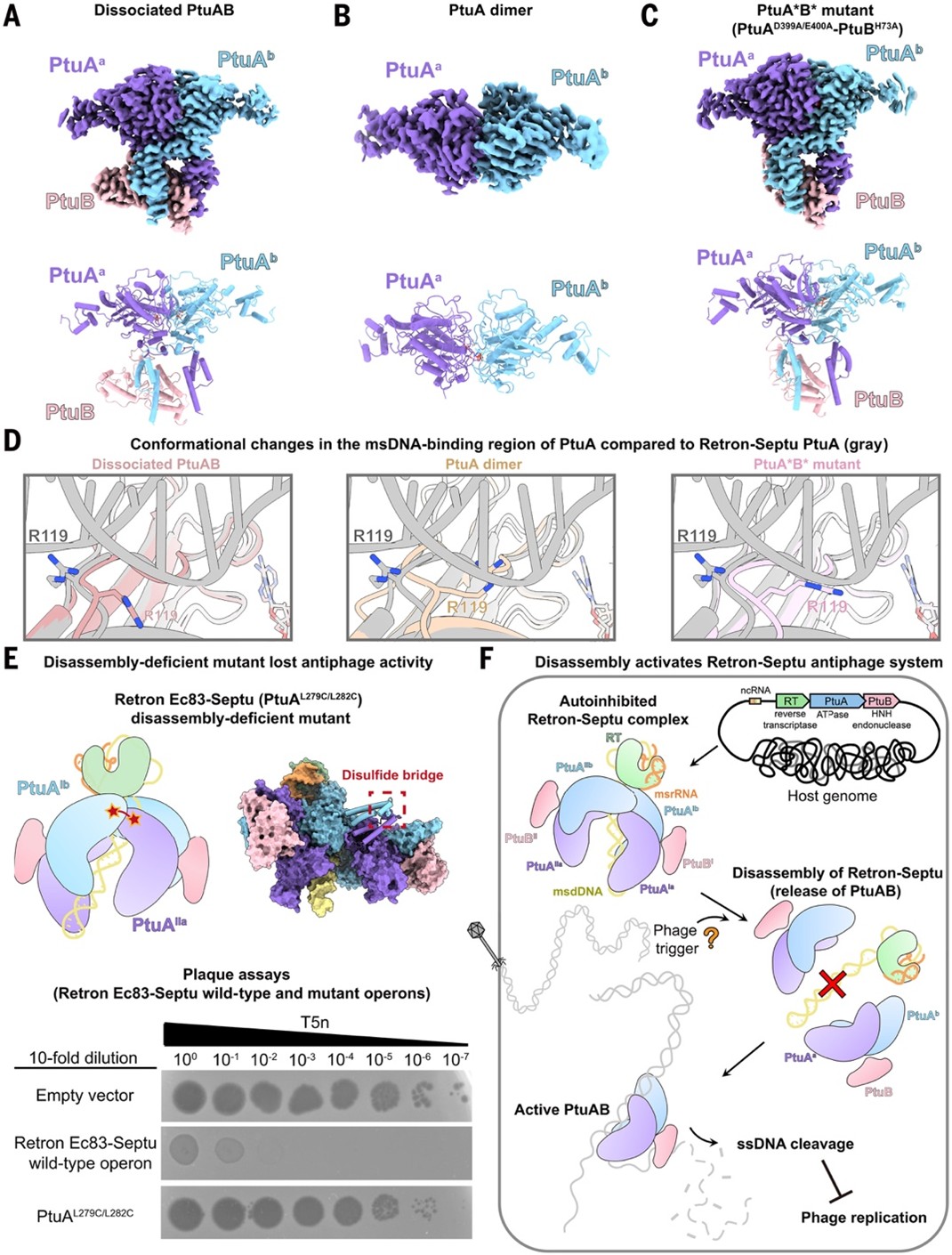
图5. retron Ec83-Septu系统通过解离释放 PtuAB启动抗噬菌体防御









