人类疱疹病毒,包括单纯疱疹病毒1型(HSV-1)、2型(HSV-2)、人类巨细胞病毒(HCMV)和Epstein-Barr病毒(EBV),对全球公共卫生构成了重大威胁。这些病毒的包膜中至少含有十种不同的糖蛋白,这些糖蛋白在宿主细胞趋向性、附着及侵入过程中发挥关键作用。其中,糖蛋白B(glycoprotein B, gB)是进化上最为保守的一种,它通过从融合前(prefusion)构象向融合后(postfusion)构象发生大规模结构重排,从而介导病毒与宿主细胞的膜融合。然而,由于难以在结构上捕捉并利用其亚稳态的融合前构象,目前尚未开发出针对融合前gB的中和抗体的抗病毒药物。

亚单位疫苗开发的最新进展表明,融合前稳定的病毒膜融合糖蛋白具有激发中和活性的潜力。由于病毒必要的膜融合蛋白处于融合前构象,暴露的独有的表位可以被中和抗体靶向,从而阻止病毒侵入细胞。在疱疹病毒中,膜融合蛋白糖蛋白B(gB)是所有疱疹病毒中保守性最高的糖蛋白。然而,由于gB融合前构象的亚稳态特性,其结构解析和靶向干预手段的开发一直面临挑战。
如果从膜中提取分离gB,会导致gB不可逆地转变为融合后构象。因此,为了保持gB的融合前构象,研究团队使用表面具有融合前构象gB的胞外囊泡,对羊驼免疫产生针对gB的纳米抗体(图1)。在测试的17种纳米抗体中,有2种显示出抑制空斑形成的效果,其中只有一种(Nb1_gbHSV)在低浓度下表现出一致的抑制效果, 其半最大抑制浓度为1.2nM。
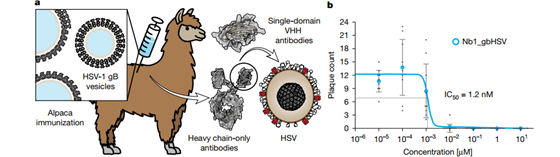
图1. 纳米抗体的生成与筛选
为了确定纳米抗体的结构表位,研究团队引入了点突变以限制gB从融合前构象向融合后构象的转变。基于之前的HSV-1 gB模型,设计了使用不同稳定手段(引入二硫键、加强疏水相互作用等)的突变,并通过电子显微镜断层扫描确认其在细胞表面的表达状态(图2)。为了确保即使在没有膜环境的情况下 gB 的融合前构象的稳定性,将所有四种稳定突变组合在一个构建体中。

图2. 分泌的gb囊泡冷冻断层扫描(橙色,融合前;蓝色,融合后)
随后,研究团队获得了2.74 Å分辨率的冷冻电镜(cryo-EM)结构揭示了HSV-1 gB的融合前全长架构(图3),但膜嵌入区域分辨率较低,说明该区域柔性较高。比较融合前和已报道的融合后构象,发现多个结构域发生重排,特别是在膜嵌入区域和融合环的排列上:N末端区域包括第90-106位残基,形成一个螺旋,该螺旋位于由β20和α83之间的短环区(氨基酸407-410)重新定位形成的DI和域DII之间的凹槽中;在DIII中的中心螺旋(αC)包含一个N末端环状区域(501-510)在融合前时呈环状,融合后延伸为长螺旋;DII中的αX螺旋在融合前中直立,而在融合后构象中平卧。
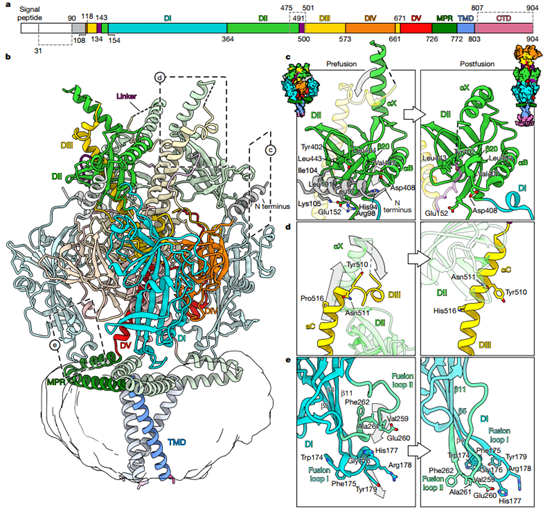
图3. gB融合前构象全长结构
值得注意的是,在融合前构象中, gB的融合环(位于DI顶端)呈“卷起”状态,形成短的310螺旋,与膜近端区(MPR)通过疏水作用和氢键(Q172–E740)相互作用。融合后构象中融合环完全伸展,若在融合前时强行伸展会与MPR发生空间冲突,说明从“卷起”到“伸展”的转变是膜融合触发的重要步骤。
另外,研究团队解析了Nb1_gbHSV与gB结合的冷冻电镜结构(图4),整体结构分辨率为3Å,阐明了其中和机制。纳米抗体同时与gB的三个不同结构域发生相互作用,形成了一个非常广泛且稳定的结合界面,共涉及23个氢键和8个盐桥,覆盖表位高达1260 Ų,结合非常紧密。纳米抗体Nb1_gbHSV对融合前gB具有皮摩尔级高亲和力(KD = 94 pM),而对融合后构象无结合能力。因此,Nb1_gbHSV通过稳定gB的融合前构象,Nb1_gbHSV可阻止其发生膜融合所必需的结构转变,进而有效抑制病毒侵入。
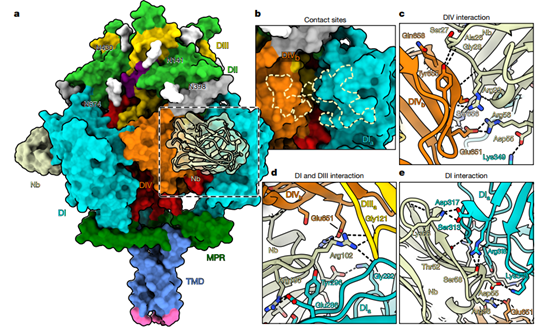
图4.Nb1_gbHSV与gB复合物结构
最后,研究团队通过对比阐释了该纳米抗体具有中和活性。研究发现能特异性结合融合前gB、不结合融合后gB的三种纳米抗体(Nb2–4_gbHSV),却不具备中和活性。这是因为这三种非中和抗体均靶向融合前构象顶部的αX螺旋区域;该处在融合后状态下因构象灵活且受邻近糖基化修饰(如N141和N398)的空间阻碍,导致抗体结合显著减弱。因此,有效的中和活性不仅依赖于对融合前构象的高亲和力与特异性,更关键的是所靶向表位需位于功能性敏感区域,即直接参与膜融合过程且不易被糖链屏蔽的位点。
为进一步证明其跨物种的中和活性,研究团队解析了HSV-2gB融合前(2.85 Å)和融合后(2.26 Å)高分辨率结构(图5)。结构比对表明,HSV-2与HSV-1的融合前结构高度保守。综合分析,研究团队推测该纳米抗体可能并未完全限制gB的整体柔性,而是阻止了融合所需的主要构象变化,由此实现了中和效果。
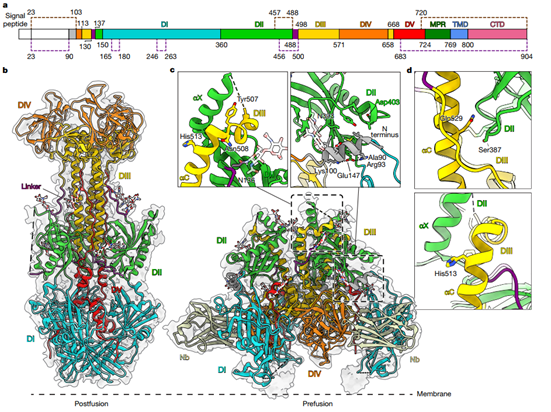
图5. Nb1_gbHSV与HSV-2 gB 复合物结构
总结来说,本研究报告了一种针对gB的融合前特异性纳米抗体,具有交叉物种的中和活性,解析了gB的全长高分辨率结构,包括其融合前和融合后构象,并描述了纳米抗体的表位和中和方式。此外,还阐释了几种融合前特异性的但非中和性的纳米抗体,它们针对gB融合前顶点的不同表位,表明融合前特异性并不一定意味着中和活性。该研究不仅深化了对病毒膜融合蛋白构象动态变化机制的理解,更为为疱疹病毒疫苗和抗病毒药物的开发提供了新的方向。









