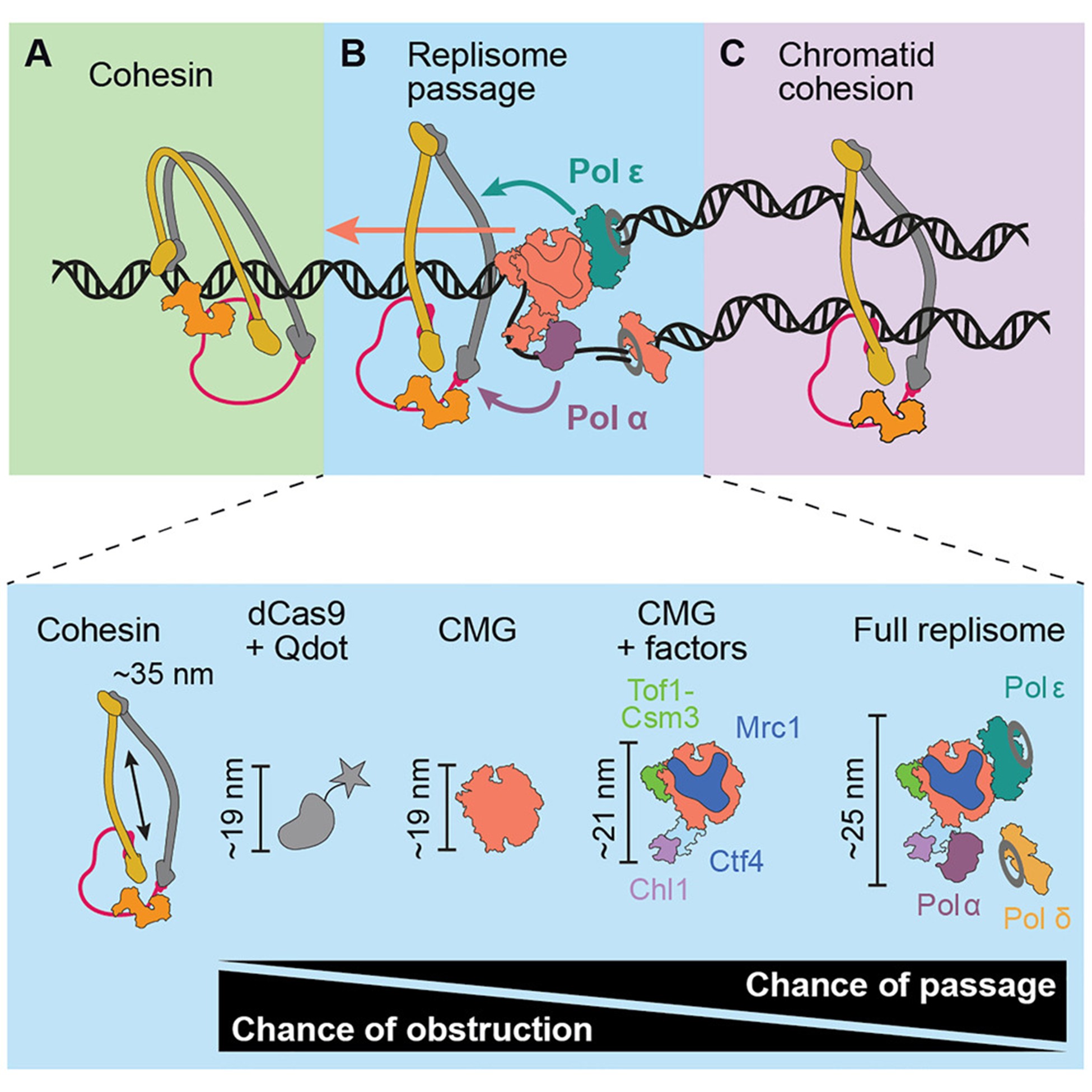
姐妹染色单体黏连依赖环状 cohesin 复合物,它在复制后同时包裹两条 DNA,从而确保染色体在有丝分裂中的准确分离。一个关键问题是:replisome在遇到 cohesin 时如何实现由单链圈入到双链共同圈入。尽管理论上 cohesin 环的孔径足以容纳replisome,但已有实验提示 cohesin 难以跨越更小的障碍物,因此replisome能否直接通过 cohesin 环仍不确定。来自伦敦弗朗西斯·克里克 (Francis Crick) 研究所的John F.X. Diffley和Frank Uhlmann团队利用生化重建和单分子荧光显微成像,直接观察了replisome与 cohesin 的相遇过程。

CMG 作为可跨越的 cohesin 屏障
研究人员首先利用单分子荧光显微镜重建并观察了出芽酵母复制性解旋酶Cdc45–Mcm2-7–GINS( CMG) 与 cohesin 的相遇过程。标记后的 cohesin 与 CMG 均保持正常活性,分别在 DNA 上呈现拓扑圈入与单向转位特性(图 1A, B)。实验发现,CMG 遇到 cohesin 时主要导致推动,但在约 10% 的事件中,CMG 能直接通过 cohesin 环,这一现象在大小相近的其他障碍物中从未观察到(图 1C)。进一步加入黏连建立因子(Ctf4–Chl1 与 Tof1–Csm3–Mrc1)后,“通过”事件频率有所增加(图 1C),提示这些因子通过与 cohesin 的互作促进了replisome跨越。结果表明,CMG 可作为可跨越的 cohesin 屏障,为replisome通过 cohesin 提供了直接实验证据。
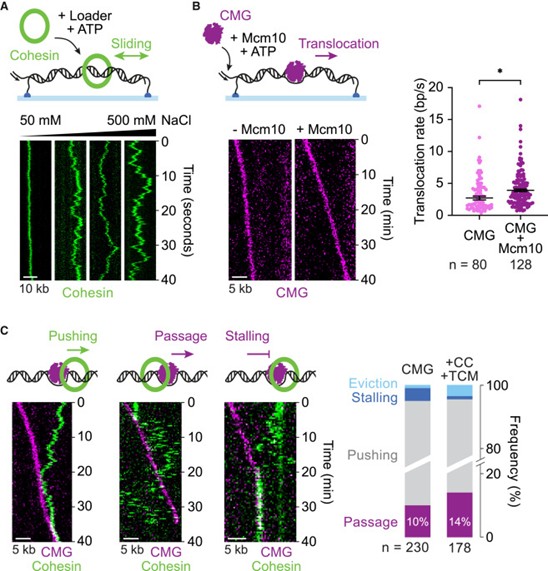
图1. CMG解旋酶可克服粘连蛋白形成的屏障
汇聚的 CMG 解旋酶可穿过 cohesin
进一步研究人员开始探索探究 cohesin 移动性对 CMG 穿过过程的影响。研究发现,cohesin 在 DNA 上的移动性会影响其与 CMG 的相遇结果:当 cohesin 静止时,CMG 更容易跨越它。通过设计双分叉 DNA 模板,研究者观察到相向运动的两台 CMG 在相遇时要么停滞(57%),要么互相通过(43%)(图 2A)。在这一过程中,夹在两台 CMG 之间的 cohesin 有约 16% 的概率成功跨过其中一台 CMG,频率高于自由扩散时(图 2B)。成功跨越后,cohesin 继续保持对 DNA 的拓扑抱持且未被驱逐(图 2C)。结果表明,当 cohesin 无法滑动逃逸时,CMG 可以迫使其解开折叠构象完成跨越,这可能依赖黏连建立因子的辅助。
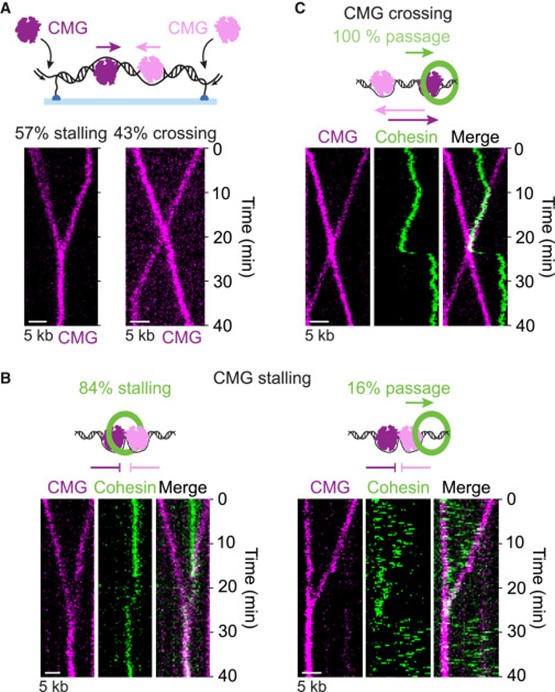
图2. cohesin通过汇聚的CMG解旋酶通道
固定化 cohesin 的 CMG 穿过过程与
相遇时的力积累
之后,研究者开始研究 CMG 与固定化 cohesin 的相互作用。当cohesin 被固定在表面后,CMG 穿越其环的概率升高至约 40%,且 cohesin 在通过后仍保持对 DNA 的拓扑结合(图 3A)。CMG 穿越过程中常出现短暂停滞并伴随“跳跃” (图 3B),提示 DNA 在停滞阶段被拉伸并在穿越后释放张力。三色 TIRF 成像证实了这一现象:停滞时CMG 前方 DNA 荧光增强,穿越后信号消退并出现跳跃(图 3C)。进一步分析显示,停滞时间越长,跳跃幅度越大,但所涉及的张力始终低于破坏 cohesin 环所需的阈值(图3C),支持了 CMG 在机械力和构象变化辅助下穿越 cohesin 的模型。
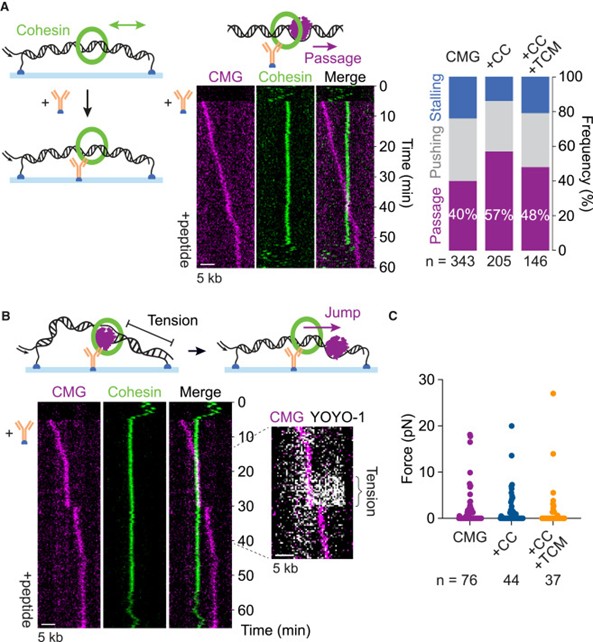
图3. CMG穿过固定化的cohesin
CMG 穿过 cohesin 环的具体方式
实验进一步探究了 CMG 穿越 cohesin 环时环本身的状态。研究人员利用侧向流实验制造出由 cohesin 固定 DNA 的 V 形构象(图4A),并观察到 CMG 在此条件下的运动。结果显示,在 CMG 穿越过程中,DNA 始终保持 V 形,不会像环打开时那样释放成直线(图 4B),说明 DNA一直被完整的 cohesin 环拓扑性包裹。虽然有约 10% 的 cohesin 会自发卸载并导致 DNA 直化,但在 CMG 穿越时未出现此现象,因此排除了环临时打开再依赖静电作用维持的可能性。综合结果表明,CMG是通过完整的 cohesin 环穿越,而非依赖环的短暂解开。
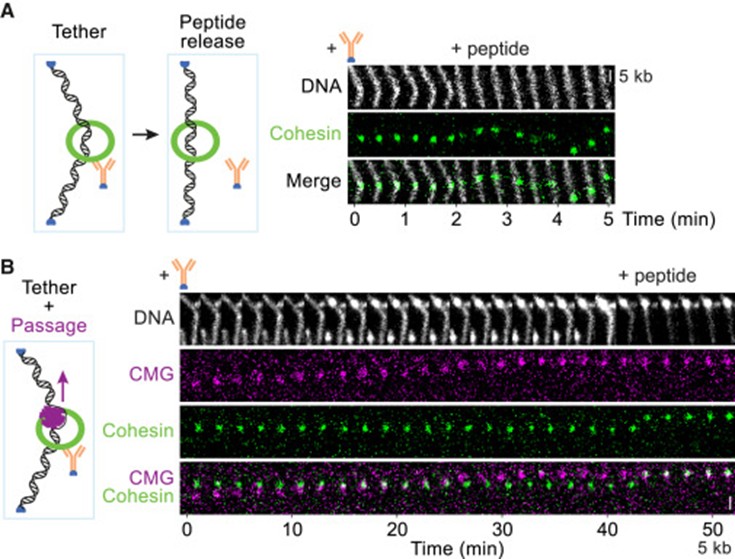
图4. 粘连蛋白在CMG传递过程中保持DNA关联
姐妹染色单体 cohesion 的建立与replisome
对 cohesin 穿过的促进作用
之后研究展示了完整真核replisome在遇到 cohesin 时的行为。实验发现,replisome遇到 cohesin 时大多数情况下将 cohesin 推在前方前进,但约 18% 的情况下replisome能成功穿越 cohesin 环(图5 A-C)。穿越后,绝大多数事件(31/42)导致姐妹染色单体黏连的建立,这一过程可直接通过实时成像观察到(图 5B)。若replisome在 DNA 模板早期遇到 cohesin,黏连建立的概率较低,而在后期几乎总能形成稳定黏连,说明合成的 DNA 越多,越不容易逃离 cohesin 环。此外,replisome在遇到固定的 cohesin 时穿越效率进一步提高,并通过力学测量表明其施加的张力仍低于破坏 cohesin 环的阈值(图 5D),提示replisome额外组分有助于 cohesin 的顺利通过与黏连的建立。
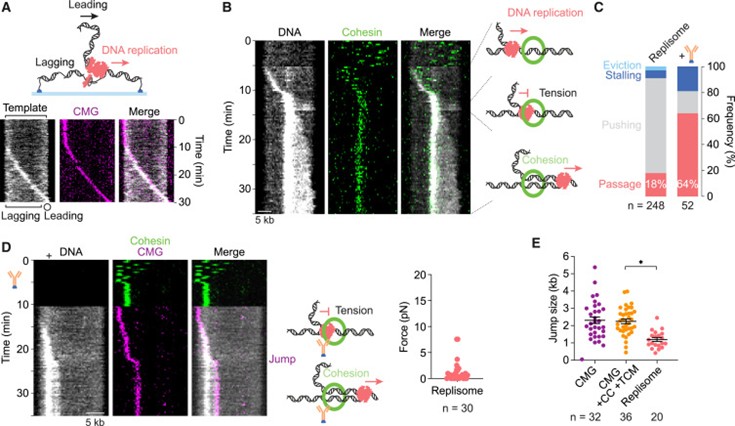
图5. replisome穿过粘连蛋白环
replisome穿过 cohesin 环的分子决定因素
研究人员开始探讨replisome比单独 CMG 更高效穿越 cohesin 环的分子基础。结果显示,已知的黏连建立因子(Chl1、Tof1-Csm3、Mrc1)在完整replisome背景下并未显著影响穿越频率或黏连建立效率(图 6A)。相比之下,去除 DNA 聚合酶显示了不同效应:缺失 Pol δ 仅轻度降低穿越效率(图 6B);缺失 Pol ε 明显降低穿越,而补充缺失催化结构域的截短 Pol ε 可以恢复穿越,提示 Pol ε C 端的非催化作用域在其中发挥关键作用(图 6B);最显著的是缺失 Pol α 时,replisome完全无法穿越 cohesin,所有遇到的 cohesin 仅被推动或转移,说明 Pol α 在穿越过程中起着不可或缺的作用(图 6B)。这些发现揭示 DNA 聚合酶,尤其是 Pol α 和 Pol ε,承担了帮助replisome跨越 cohesin 环的核心分子角色。
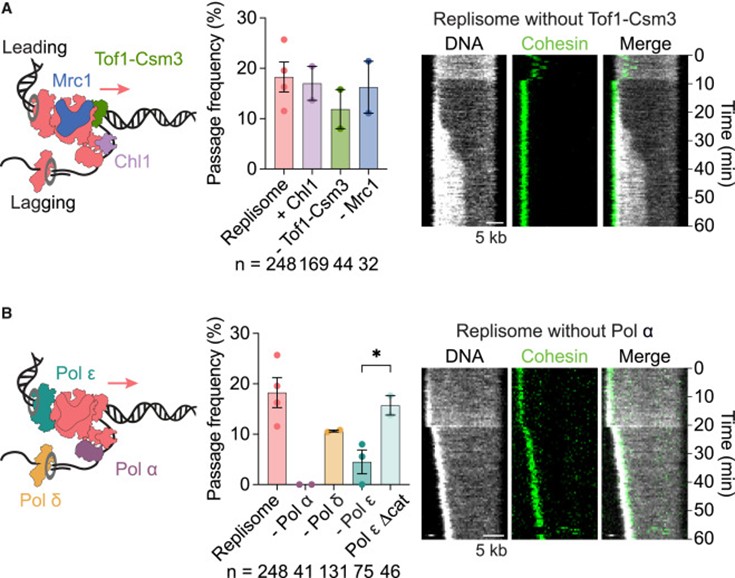
图6. Pol α和Pol ε作为cohesion建立因子
总结
本研究利用生化重建和单分子荧光显微成像,直接观察了replisome与 cohesin 的相遇过程。结果发现,正在转位的真核复制性解旋酶CMG,与其他尺寸相似的障碍物不同,能够顺利通过 cohesin 环。完全重建的replisome也能够穿过 cohesin 环,从而使两条复制产物共同被圈入其中。replisome的顺利通过主要依赖于 DNA 聚合酶 α 和 ε,这一发现需要重新审视传统的黏连建立因子作用模式。该研究表明,replisome能够穿过 cohesin 环,这一简单机制直接将基因组复制与染色体分离联系了起来。