创新药物发现的关键在于命中/先导化合物识别。传统高通量筛选受限于化合物库多样性,而从头分子设计能探索更广化学空间。尽管深度生成模型(DGMs)可生成高亲和力配体,但仍面临结合构象不可靠、分子结构不合理、缺乏优化功能及理论与实验差距等挑战。

模型概览
ED²Mol是一种基于电子密度(ED)的结构感知深度生成模型,其通过变分自编码器(VAE)从口袋结构推断配体ED分布(图1b),并采用峰值密度搜索算法拟合核心,结合等变图神经网络(EGNN)迭代扩展片段至未占据ED区域(图1b)。该模型支持以预定义核心为基础进行片段级优化(图1c),具备生成多样化定制先导化合物的能力(图1d)。
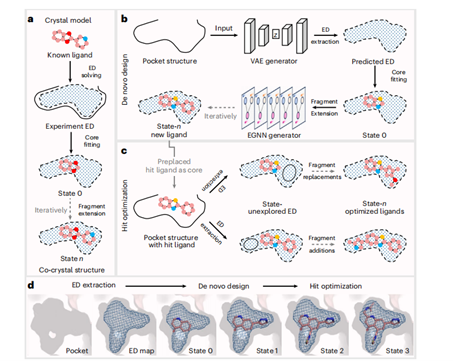
图1 | ED²Mol的架构和工作流程
从头生成的模型性能
一个有效的口袋感知三维深度生成模型(DGM)需满足两个关键设计标准分子间需精准学习配体几何分布以生成最优结合模式(通过结合位点、效率、有效性及稳定性量化);分子内需掌握药理学相关分布以确保生成分子具备可合成性、类药性及结构多样性。
生成分子的结合模式可靠性
ED²Mol在口袋感知生成中全面领先(图2a-c):其口袋占有率密度(28.2)和覆盖率(84%)显著优于基线模型;配体效率(LE)在DUD-E/ASB-E达67.3%/68.9%;结合有效性(PoseBusters)达97.3%,冲突与失真最少;重新对接稳定性最高(图2b),RMSD<2Å的姿势保真度超次优模型12.7-15.9%;最终可靠成功率34.4%(图2c),为基线两倍以上,证明其高质量配体生成能力。
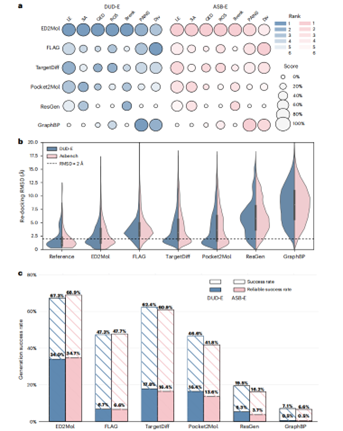
图2 | 使用DUD-E(蓝色)和更具挑战性的ASB-E(红色)数据集对DGMs的性能进行比较
生成分子的药理学理想特性
ED²Mol在类药性与可合成性评估中全面领先(图2a):其可合成性(SA)、类药性(QED)、利平斯基五规则(RO5)符合度及布伦克规则通过率四项关键指标最优,且PAINS问题官能团最少;药代动力学特性(膜通透性、代谢稳定性、口服生物利用度)及先导化合物多样性均达最佳水平,结构多样性与基线相当。
从从头设计到命中优化
ED²Mol通过基于片段的微调工作流程(图1c),以已知活性分子为核心直接进行片段替换或添加(如Brr2抑制剂替换、PPARγ激活剂扩展),系统性增强配体-受体相互作用,有效填补了从自动化设计到全流程药物生成的技术空白。
通过片段替换设计Brr2抑制剂
在Brr2抑制剂优化中(图3a-b),ED²Mol基于核心骨架(PDB:5URJ)通过ED引导的片段替换,探索T1197/F1255/K1716残基附近亚口袋,生成分子亲和力优于基线且成功复现先导化合物9(RMSD=0.56Å)。其产生两类优化分子:高相似性类(相似度0.71)通过新增氢键提升亲和力;低相似性类通过磺酰胺基团维持极性作用并扩展疏水接触,证明其多样化片段替换能力。
通过片段添加设计PPARγ激活剂
在PPARγ激活剂优化中(图3c-d),ED²Mol以共晶结构(PDB:3ET0)为输入,成功识别R288/Y327/L330/S342残基周围的亚口袋扩展空间。其生成分子亲和力显著优于基线,并唯一复现先导激活剂3(RMSD=0.95Å)。高相似性组保留磺酰基-Y327氢键,新增S342极性及R288/L330非极性作用;低相似性组通过替代酰胺基维持相互作用,证明其多样化片段添加能力。
从基准评估到湿实验室验证
为验证ED²Mol的实用性,作者通过五个湿实验案例(包括FGFR3抑制剂生成与优化、CDC42/GCK/GPRC5A别构调节剂设计)证明其能力(图4-6相关)。这些靶点(如FGFR3、CDC42等)在抗肿瘤和糖尿病治疗中重要性明确但药物稀缺,ED²Mol通过扩展化学空间成功生成活性化合物,填补了药物发现空白。
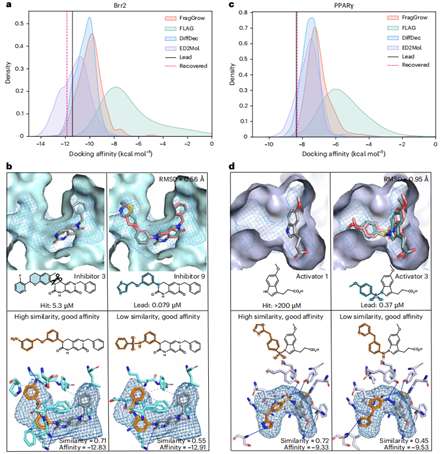
图3 | 回顾性命中优化案例研究
FGFR3正构抑制剂的生成和优化
在FGFR3抑制剂开发中(图4a-e),ED²Mol基于ATP口袋(PDB:4K33)生成分子,经筛选得687候选物。化合物F4经SPR验证结合(KD=599.0μM),共晶结构(1.4Å)证实预测一致性(RMSD=2.00Å)及氟苯基诱导构象变化(图4c)。优化后F42(图4d)KD提升至61.4μM(效力提高9.8倍),源于占据L624疏水亚口袋(图4e),证明其高效生成与优化能力。
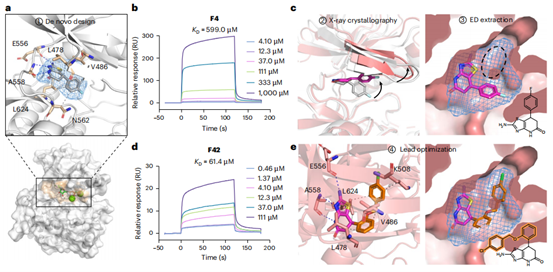
图4 | 通过应用ED²Mol发现新的FGFR3正构抑制剂
CDC42别构抑制剂的从头生成
在CDC42别构抑制剂开发中(图5a-b),ED²Mol基于复合物结构(PDB:2ODB)生成分子,经筛选获1,547个候选物。化合物C1通过π-π堆积与F37作用,预测结合模式与对接一致(RMSD=0.82Å)。实验验证C1抑制活性(IC50=47.58μM),SPR结合KD=5.35μM;类似物C11亦具活性(IC50=111.63μM),证明其能高效生成靶向PPI别构口袋的先导化合物。
GCK别构激活剂的优化
在GCK激活剂优化中(图5c-e),ED²Mol基于新亚口袋结构(PDB:3GOI)从G0出发生成分子,筛选得995候选物。化合物G1(EC50=290nM,效力提升6.1倍)和G11(EC50=150nM,提升11.9倍)因合成可行性与亚口袋占据优势被验证,证明其通过片段扩展有效增强别构激活剂活性。
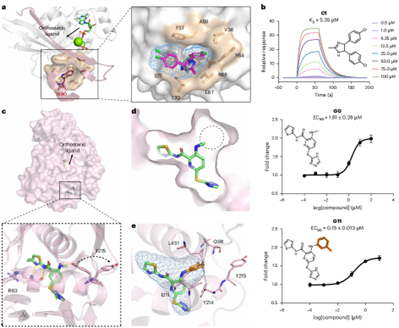
图5 | 通过应用ED²Mol发现新的CDC42别构抑制剂和GCK别构激活剂
GPRC5A别构调节剂的从头生成
在GPRC5A孤儿受体激活剂开发中(图6a-d),通过整合AlphaFold 3结构预测(图6a)、AlloSite口袋检测(图6b)及ED²Mol分子生成,构建“序列到命中”框架。筛选获1,603候选物,化合物A4因结合模式与预测一致(RMSD=1.48Å)及合成可行性被选中(图6c)。实验验证A4为激活剂(EC50=8.94μM)(图6d),证明其能破解孤儿受体药物发现难题。
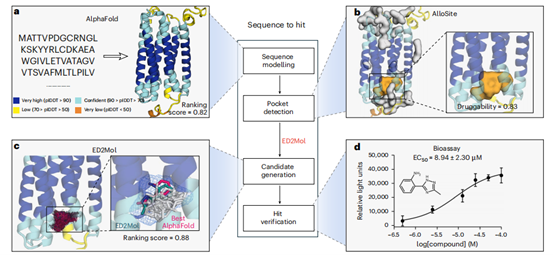
图6 | 通过整合应用ED²Mol发现新的GPRC5A别构调节剂
总结
ED²Mol通过利用电子密度(ED)图作为生成线索,实现了基于结构的分子设计与优化,其多功能性在湿实验验证中得到充分体现:成功为FGFR3(正构抑制剂)、CDC42(别构抑制剂)、GCK(别构激活剂)及孤儿受体GPRC5A(别构激活剂)生成活性化合物,涵盖多种口袋类型和配体功能,证明了跨靶点应用的稳健性。当前片段库虽平衡效率与效果,但存在骨架偏好性;未来可通过扩展库多样性(如引入天然产物类结构)、结合强化学习优化结合亲和力或药理学特性(如低毒性),进一步提升其临床前研究价值。









