2025.10.20~2025.10.26
CNS刊登文章
01
Nature
2025/10/22
1.“Bottom-up design of Ca2+ channels from defined selectivity filter geometry”
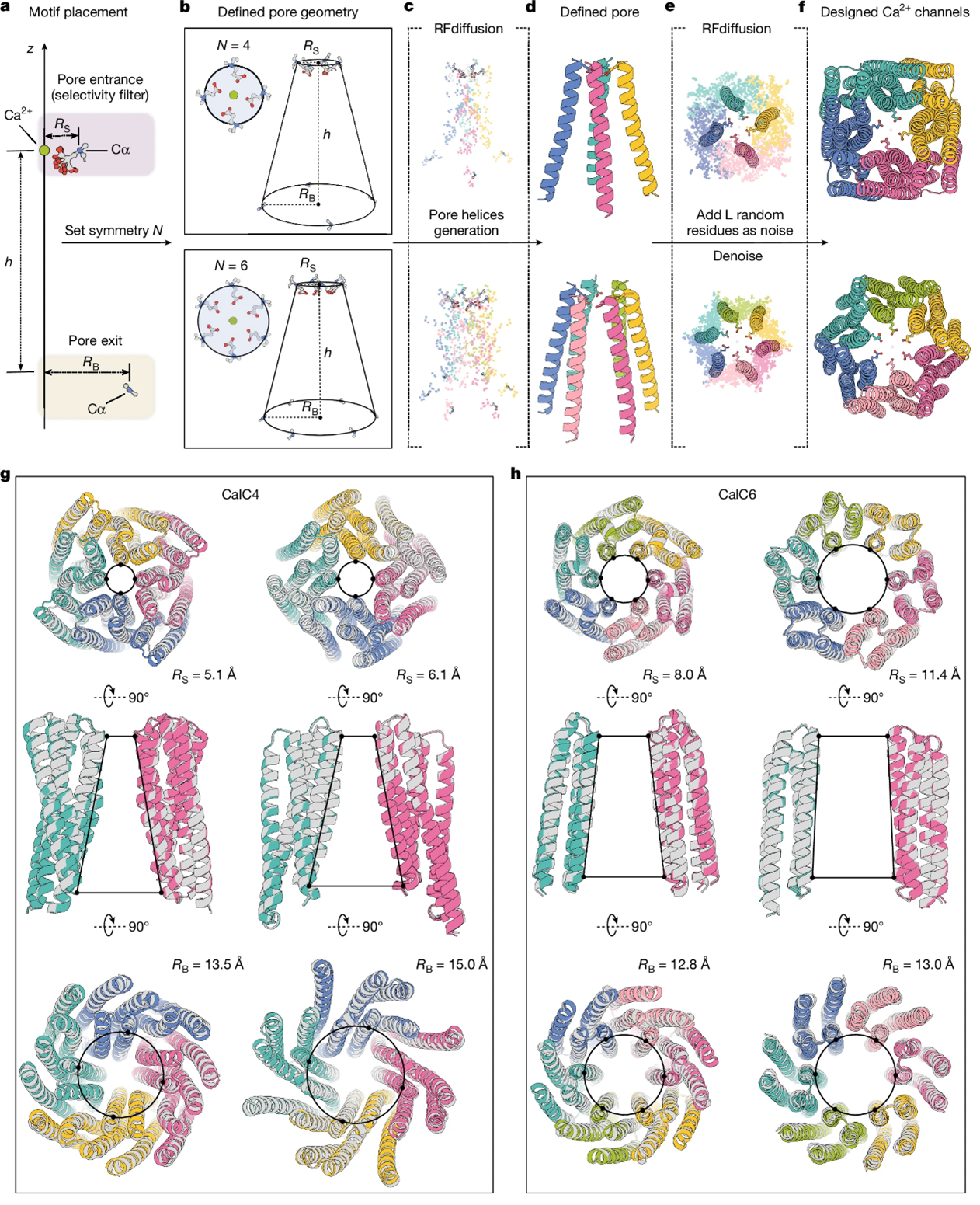
天然离子通道在生物系统中发挥着关键作用,且工程化版本广泛应用于化学遗传工具和传感设备中。蛋白质设计已被用于构建含孔的跨膜蛋白,但由于缺乏精确放置金属配位残基的方法,设计具有特定氨基酸侧链排列的选择性滤器(这是天然离子通道的关键特征)一直受到限制。
来自美国华盛顿大学David Baker课题组描述了一种基于RFdiffusion的自下而上的方法,利用该方法从定义的选择性滤器残基几何结构构建Ca2+通道,并利用这一方法设计了具有不同配位数和不同几何形状的Ca2+选择性滤器的对称寡聚体通道,这些选择性滤器位于一个较宽的孔入口处,该孔由多个跨膜螺旋支撑。所设计的通道蛋白组装成均匀的含孔颗粒,且无论是四聚体还是六聚体的离子配位配置,膜片钳实验表明,所设计的通道对Ca2+的导电性高于Na+和其他二价离子(Sr2+和Mg2+),这些离子在选择性滤器残基突变后被排除。冷冻电镜结果表明,这一设计方法具有很高的准确性:六聚体Ca2+通道的结构几乎与设计模型相同。研究者的自下而上的设计方法现在可以通过直接构建来测试滤器几何形状与离子选择性之间的假设,并为创建适用于广泛应用的选择性离子通道提供了路线图。
2025/10/22
2. “Designing allosteric modulators to change GPCR G protein subtype selectivity”
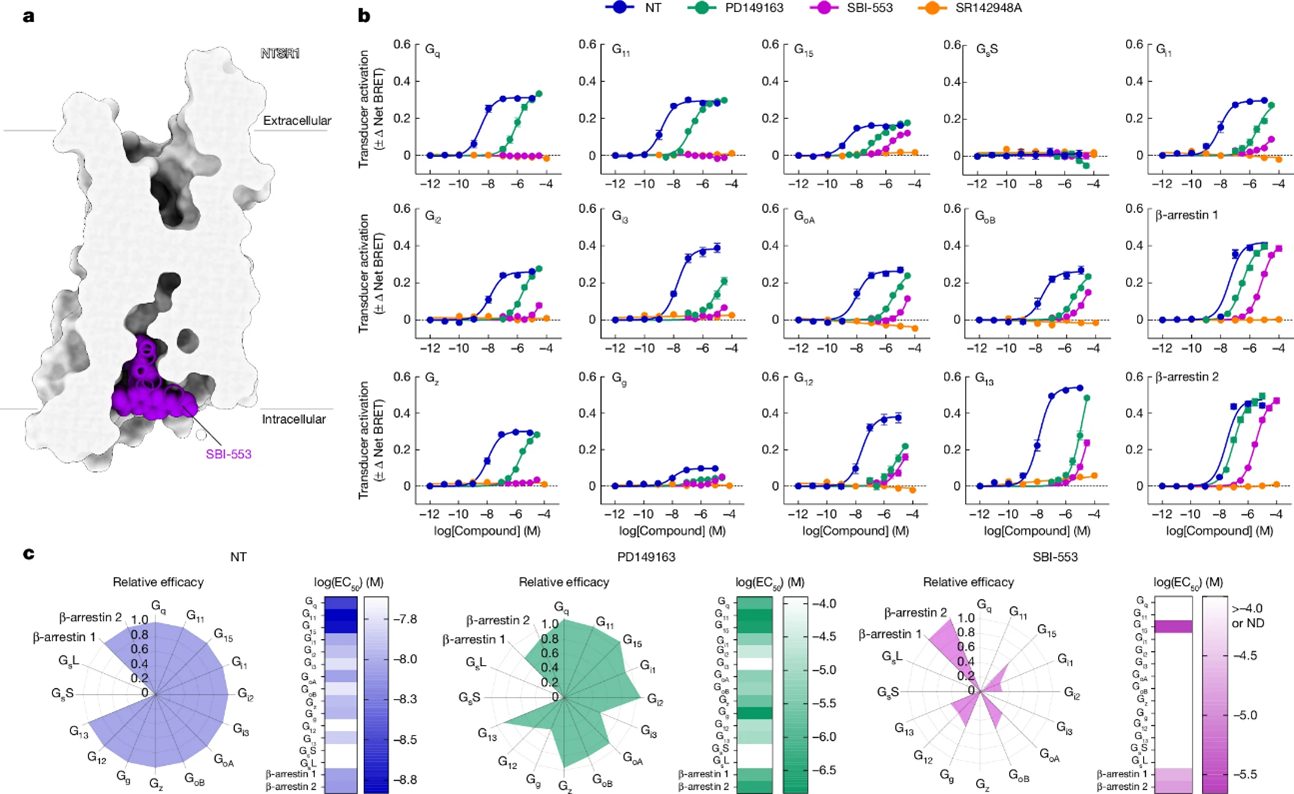
G蛋白偶联受体(GPCRs)通过16种亚型的Gα蛋白和两种β-arrestin蛋白将细胞外信号转化为细胞内反应。偏向性化合物——那些优先激活这些蛋白亚集的分子——通过更有选择性地激活与治疗相关的通路,承诺成为比均匀激活所有通路的化合物更安全、更有效的药物。然而,偏向性的决定因素尚不清楚,我们缺乏能够选择特定G蛋白的理性设计分子。
来自美国明尼苏达大学Lauren M. Slosky课题组以典型的A类GPCR神经肽受体1(NTSR1)为例,展示了与GPCR-转导蛋白接口结合的小分子通过亚型特异性和可预测的机制改变G蛋白耦合,进而实现结构引导的药物设计。研究者发现,细胞内核心结合化合物SBI-553通过直接的分子间相互作用改变NTSR1的G蛋白偏好,促进或防止与特定G蛋白亚型的结合。对SBI-553骨架的修改产生了具有不同G蛋白选择性谱的变构调节剂。选择性谱与探针无关,在不同物种中保持一致,并且转化为体内活性的差异。研究表明,G蛋白选择性可以通过对单一化学骨架的小幅改动,针对受体-转导蛋白接口来量身定制。此外,鉴于这一口袋在广泛物种中保守,此发现可能为通路选择性药物发现提供了一种策略,这一策略适用于多样化的GPCR超家族。
02
Science
本周无
03
Cell
2025/10/22
1.“Structural basis for the concurrence of template recycling and RNA capping in SARS-CoV-2”
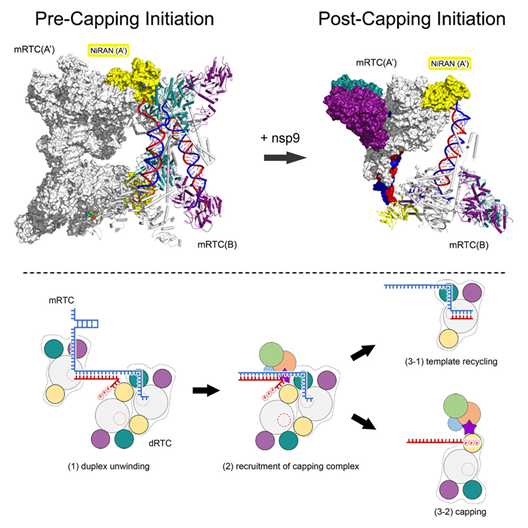
在SARS-CoV-2的复制转录复合体(RTC)中,正在合成的模板-产物双链被解开,形成一个用于循环利用的模板链和一个需要加帽的产物链。
来自清华大学娄智勇和饶子和、中国医学科学院北京协和医院朱兰团队合作解析了SARS-CoV-2 RTC在加帽起始(CI)前后状态的结构。在CI前状态下,RTC具有二聚体-二聚体结构(ddRTC)。一个RTC中的上游RNA双链通过另一个RTC中头对头位置的解旋酶以3′–5′方向相互解开。解旋酶在其ATP结合口袋中结合ADP或ADP⋅Pi,提示了一种由ATP水解驱动的解旋机制。在CI后状态中,nsp9与nsp12关联的nidovirus RdRp相关核苷酸转移酶(NiRAN)结合,破坏了ddRTC。nsp9的N端和产物链的三磷酸化5′末端共同定位于NiRAN的催化位点,表现出nsp9 RNA化加帽前的状态。这些结果提供了对SARS-CoV-2 RTC中模板循环利用和RNA加帽同时进行的洞察。
2025/10/24
2.“Unveiling conformation-selective regulation of the norepinephrine transporter”
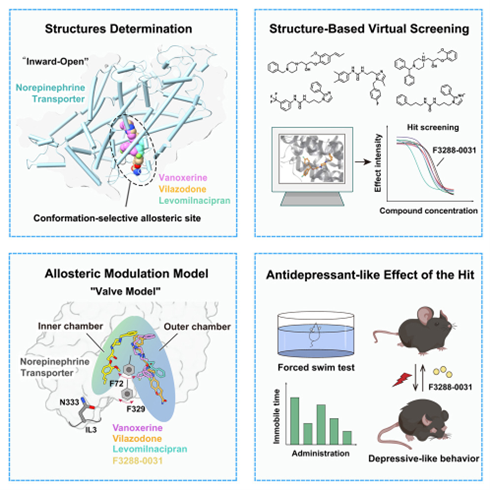
去甲肾上腺素转运蛋白(NET)在突触神经传递中发挥着关键作用,并与重度抑郁症和注意力缺陷/多动障碍(ADHD)相关。然而,我们对其别构性、构象选择性调节的理解——这一点对开发靶向治疗至关重要——仍然有限。
通过对NET与左米那普仑、伐诺司林和维拉佐酮的复合物进行冷冻电镜分析,来自中国科学院上海药物研究所徐华强、杨德华,联合临港实验室蒋轶、王震团队共同发现了NET内侧前庭中一个先前未定义的别构位点,该位点使构象选择性调节成为可能。这个发现提出了一个“阀门模型”,在该模型中,特定残基将细胞质腔分割成不同的腔室,决定了抑制剂的结合特异性。通过虚拟筛选,研究者利用这一结构见解,发现了一组具有NET抑制活性的抑制剂,并展示了它们的抗抑郁作用。此外,研究者对抑制剂在这一构象选择性位点上的占据的结构鉴定,为靶向治疗干预提供了一个机制框架。这些发现加深了我们对NET别构调节的理解,提供了一个结构引导的框架,用于开发下一代抗抑郁药物,针对NET的向内开放构象,以治疗神经精神疾病。
2025.10.20~2025.10.26
子刊刊登文章
01
Cell Research
10.23
02
Molecular Cell
10.23
“A structural basis for chaperone repression of stress signaling from the endoplasmic reticulum”
03
Nature Structural & Molecular Biology
10.24
“Structural basis for agonist and heat activation of nociceptor TRPM3”
04
Nature Communications
10.20
10.20
2.“Apolipoprotein A-IV fibrils: structural diagnosis of mixed cardiac amyloidosis”
10.21
10.22
10.22
5.“Structural mechanism of the agonist binding on human TRPC3 channel”
10.22
6.“Computational design and evaluation of optimal bait sets for scalable proximity proteomics”
10.23
10.23
8.“Visualizing influenza A virus assembly by in situ cryo-electron tomography”
10.23
10.23
10.24
10.24
12.“Global comparative structural analysis of responses to protein phosphorylation”
10.24
13.“Structural basis for transport and inhibition of the human glucose-6-phosphate transporter G6PT”
05
Science Advances
10.22
“In situ characterization of mitochondrial Hsp60-Hsp10 chaperone complex under folding stress”









