2025.11.17~2025.11.23
CNS刊登文章
01
Nature
2025/11/19
1.“Structural basis of regulated N-glycosylation at the secretory translocon”
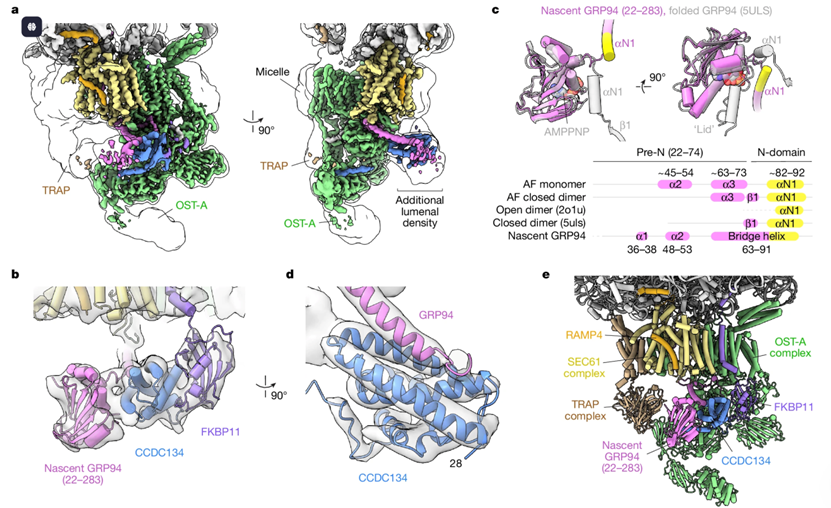
大多数人体分泌途径中的蛋白质在进入内质网(ER)时,会被寡糖基转移酶(oligosaccharyltransferase,OST)复合物进行 N-糖基化。最新研究揭示了一种由底物辅助的机制,即通过调控伴侣蛋白 葡萄糖调节蛋白 94(GRP94) 的 N-糖基化来控制细胞表面受体信号传导。
来自美国芝加哥大学的Robert J. Keenan和斯坦福大学医学院的Rajat Rohatgi团队合作报告了天然分离的 GRP94 折叠中间体结构,该中间体被锚定在一种特殊的结合 CCDC134 的易位通道(translocon)上。结合功能分析,这些数据揭示了 GRP94 中一段保守的 N 端延伸序列如何抑制 OST-A 的糖基化活性,以及易位通道内部的结构重排如何保护被锚定的新生链,避免其被 OST-B 错误糖基化。上述相互作用依赖于 CCDC134 上的一个疏水沟槽,它能够识别 GRP94 的非天然构象。研究者的结果阐明了一种受调控的 N-糖基化机制,并展示新生链如何重塑易位通道以促进自身生物发生。
2025/11/19
2.“ZAK activation at the collided ribosome”
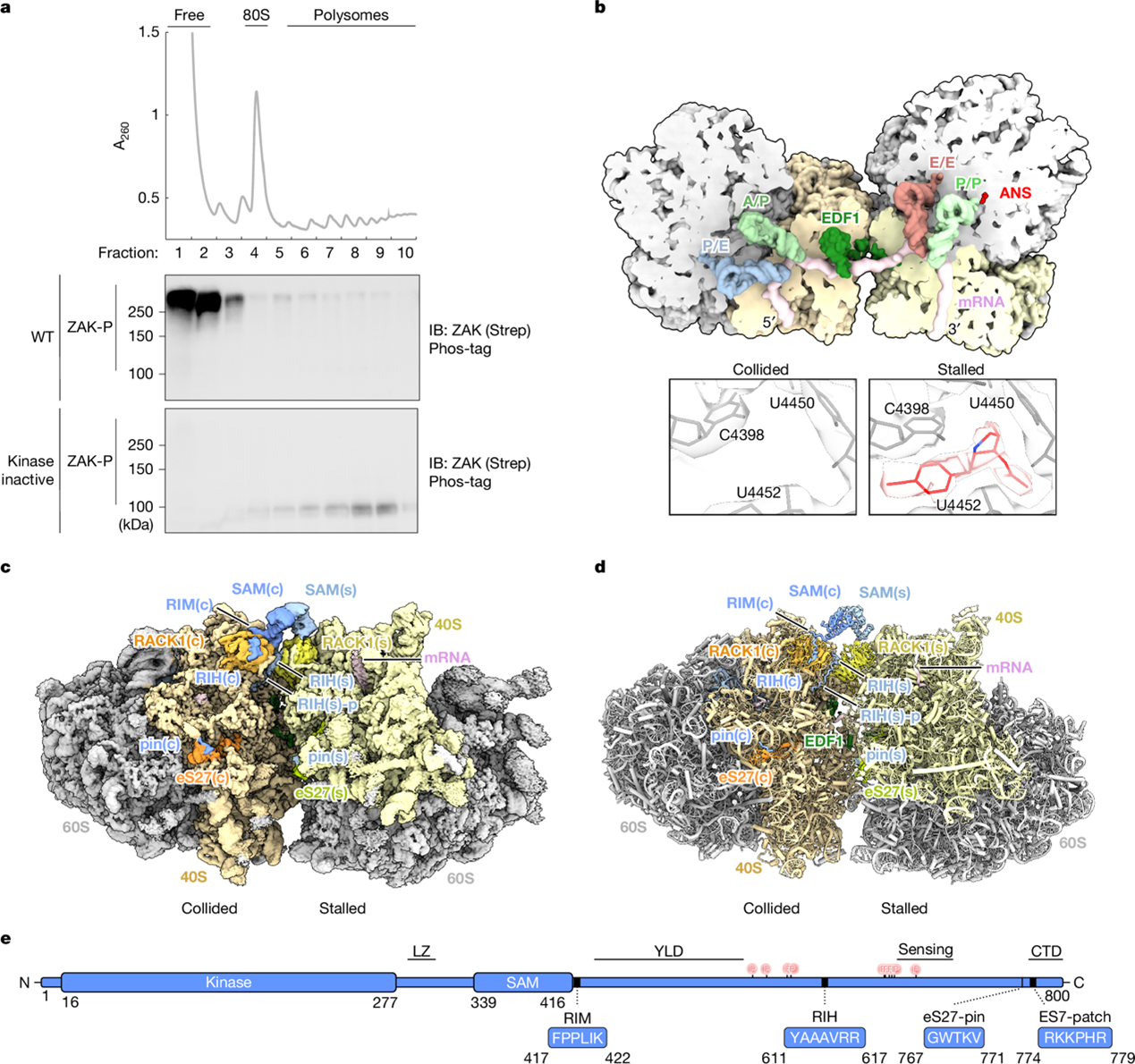
核糖体碰撞会激活由 MAP3K ZAK 介导的 核糖体毒性应激反应(ribotoxic stress response),ZAK 随后通过下游磷酸化 MAPKs p38 和 JNK1 来调控细胞命运。然而,尽管 ZAK 在细胞应激中发挥关键作用,其与核糖体相互作用的机制和结构基础,以及这些相互作用如何导致其激活,仍不清楚。
来自德国慕尼黑大学的Roland Beckmann和美国约翰斯·霍普金斯大学医学院的Rachel Green团队合作结合生物化学与冷冻电镜技术,发现了 ZAK 与核糖体之间两类不同的相互作用:一种负责其持续募集(constitutive recruitment),另一种负责其激活(activation)。研究者发现,在诱导核糖体碰撞后,ZAK 与核糖体蛋白 RACK1 的相互作用使其能够在碰撞界面通过 SAM 结构域二聚化 而被激活。此外,研究者揭示了核糖体结合蛋白 SERBP1 如何通过负向调控这一过程,防止 ZAK 被持续性激活。研究者进一步表征了新的 SAM 结构域突变体以及一个已知的 ZAK 致病突变体,结果支持 SAM 结构域在调控 ZAK 激酶活性(无论其是否结合核糖体)中具有关键作用,其中部分突变能够绕过 ZAK 对核糖体结合的依赖,从而实现激活。综上,本研究为 ZAK 在核糖体碰撞界面上的激酶活性提供了机制性蓝图。
02
Science
本周无
03
Cell
2025/11/20
“Elucidating pathway-selective biased CCKBR agonism for Alzheimer’s disease treatment”
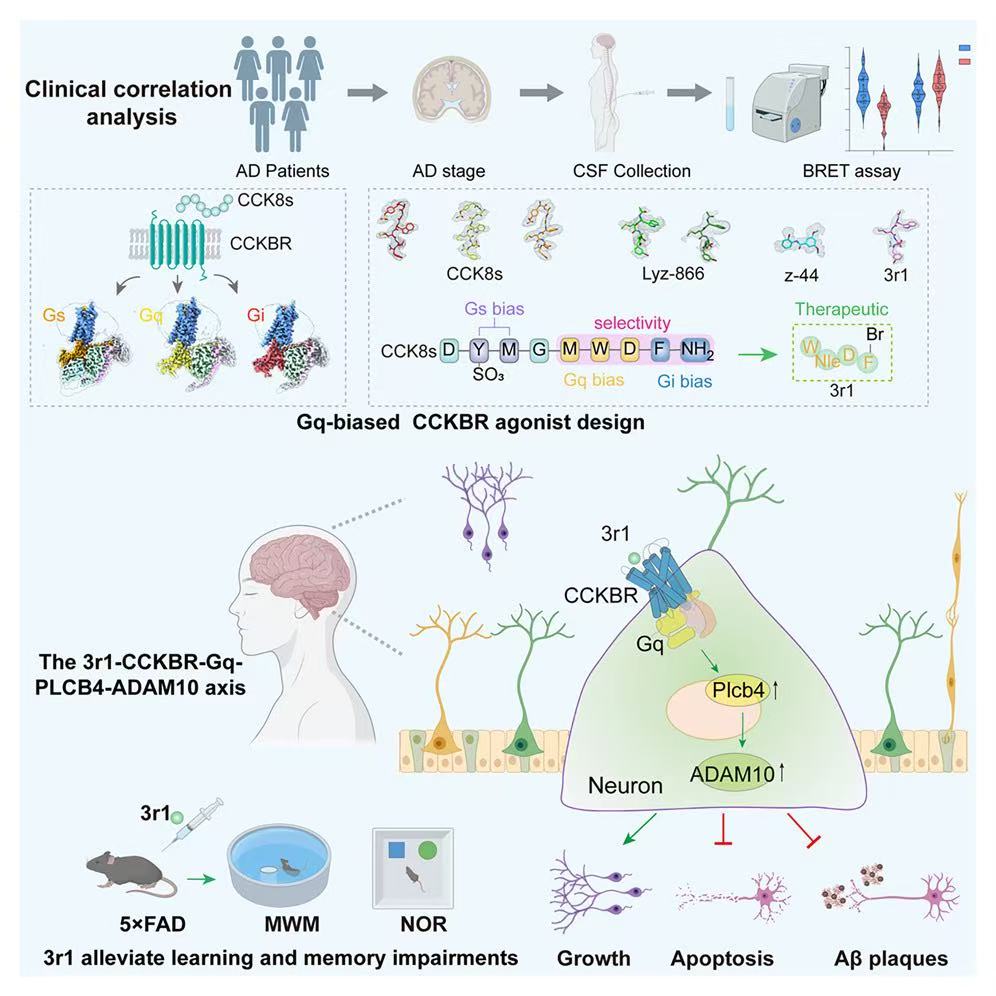
胆囊收缩素(CCK)B 受体(CCKBR)在内嗅皮层(EC)中表达,并在记忆和学习中发挥重要作用。
来自北京大学孙金鹏联合香港城市大学贺菊芳、北京大学张勇、铁璐、香港中文大学(深圳)杜洋以及北京宣武医院唐毅团队合作发现 CCKBR-Gs 和 CCKBR-Gq 信号,而不是 CCKBR-Gi 信号,有利于阿尔茨海默病(AD)的治疗。临床上,AD 更严重的患者与更低的 CCKBR-Gq 活性相关。CCKBR与内源性激动剂硫酸化 CCK8(CCK8s) 以及三种不同 G 蛋白亚型形成复合物的冷冻电镜(cryo-EM)结构显示,不同的受体构象有助于选择性 G 蛋白偏向。基于这些结构洞察,研究者理性地开发了合成的CCKBR激动剂,其中包括 Gi-偏向的激动剂(z-44)和 Gq-偏向的激动剂(3r1)。值得注意的是,3r1 通过改善 5×FAD 小鼠的认知下降、减少淀粉样蛋白-β 斑块数量、以及通过上调 α-分泌酶(ADAM10) 和钙信号分子 PLCB4 来促进长期增强效应(LTP),表现出治疗潜力。研究结果表明,靶向 CCKBR-Gq信号的合成偏向激动剂对AD具有治疗潜力。
2025.11.17~2025.11.23
子刊刊登文章
01
Cell Research
本周无
02
Molecular Cell
11.18
03
Nature Structural & Molecular Biology
11.17
1.“Filament formation and NAD processing by noncanonical human FAM118 sirtuins”
11.17
2.“Computational design of a high-precision mitochondrial DNA cytosine base editor”
04
Nature Communications
11.17
11.18
2.“Structural basis of vilazodone dual binding mode to the serotonin transporter”
11.18
3.“Energetic profiling reveals thermodynamic principles underlying amyloid fibril maturation”
11.18
11.18
5.“A degron-mimicking molecular glue drives CRBN homo-dimerization and degradation”
11.19
6.“Closed state structure of the pore revealed by uncoupled Shaker K+ channel”
11.19
11.19
11.19
9.“Enhancing functional proteins through multimodal inverse folding with ABACUS-T”
11.19
11.20
11.“Direct detection of an NH-π hydrogen bond in an intrinsically disordered peptide”
11.20
12.“A shared mechanism for Bacteroidota protein transport and gliding motility”
11.20
11.20
11.21
15.“Molecular Basis for Catalysis and Regulation of the Strigolactone Catabolic Enzyme CXE15”
11.21
16.“ARMH2 is a cytosolic component of CatSper crucial for sperm function”
11.21
11.21
18.“Atomic structure and in situ visualization of native PMEL lamellae in melanosomes”
11.23
19.“Disentangling the mechanistic role of loop-C capping in Cys-loop receptor activation”
11.23
20.“Structural insights into scaffold-guided assembly of the Pseudomonas phage D3 capsid”
05
Science Advances
11.21
1.“Mitochondrial NAD+ gradient sustained by membrane potential and transport”
11.21
2.“A ubiquitin-like protein controls assembly of a bacterial type VIIb secretion system”









