01
Nature
2024/10/09
“Structural basis of mRNA decay by the human exosome–ribosome supercomplex”
人类外泌体-核糖体超复合体介导mRNA衰变的结构基础
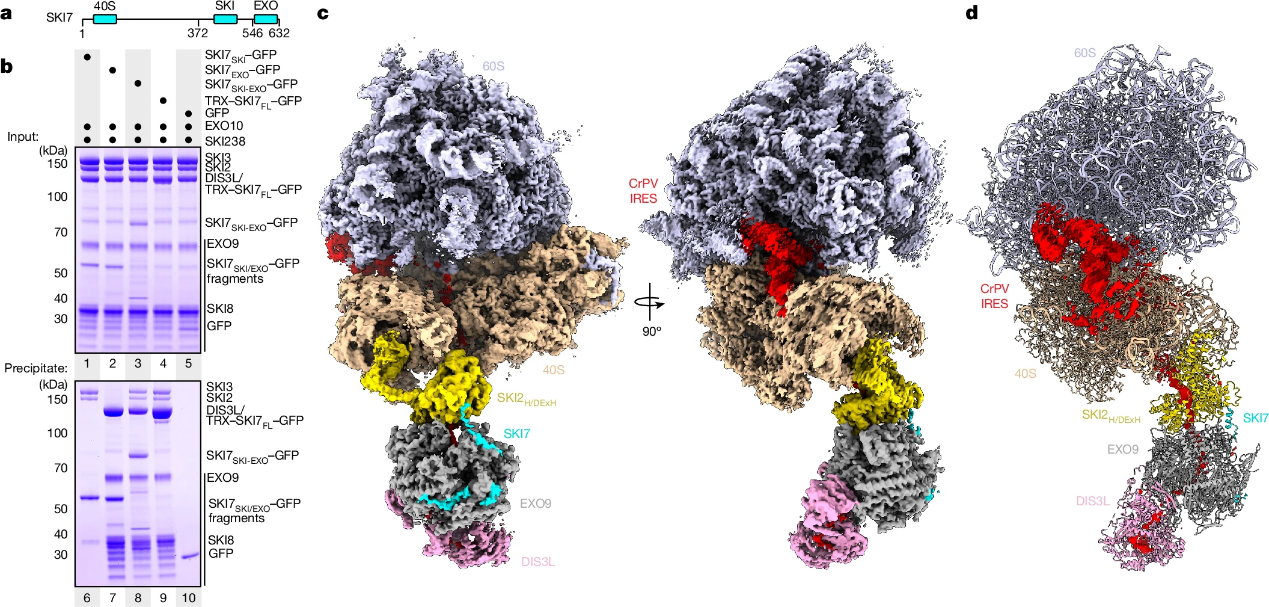
翻译和mRNA衰变之间的相互作用在人类细胞中很普遍。在质量控制途径中,与翻译核糖体相关的mRNA的外切降解主要由细胞质外泌体介导,其中包括外切核糖核酸酶复合物EXO10和解旋酶复合物SKI238。解旋酶可以从核糖体中提取mRNA,并通过桥接因子HBS1L3(也称为SKI7)将其转移到外核糖核酸酶核心,但这种分子转移的机制尚不清楚。
来自德国马克斯·普朗克生物化学研究所Elena Conti和Ingmar B.Schäfer合作揭示了人类EXO10如何被HBS1L3(SKI7)招募至活跃的核糖体结合SKI238复合物。研究者表明,不是逐步交接,而是直接物理耦合机制,最终形成了细胞质外泌体-核糖体超复合物。在活性衰变过程中捕获结构揭示了一条连续的路径,其中RNA底物从80S核糖体穿过SKI2解旋酶进入细胞质外泌体复合物的外核糖核酸酶活性位点。复合物的SKI3亚基直接与HBS1L3(SKI7)结合,也与40S亚基的表面结合,在碰撞的二体中建立识别平台。因此,外泌体和核糖体在共翻译mRNA衰变中作为一个单一的结构和功能单元协同工作,在瞬态超复合物中协调它们的活动。
02
Science
本周无
03
Cell
2024/10/08
1.“Structure of TnsABCD transpososome reveals mechanisms of targeted DNA transposition”
TnsABCD转座体的结构揭示了靶向DNA转座的机制
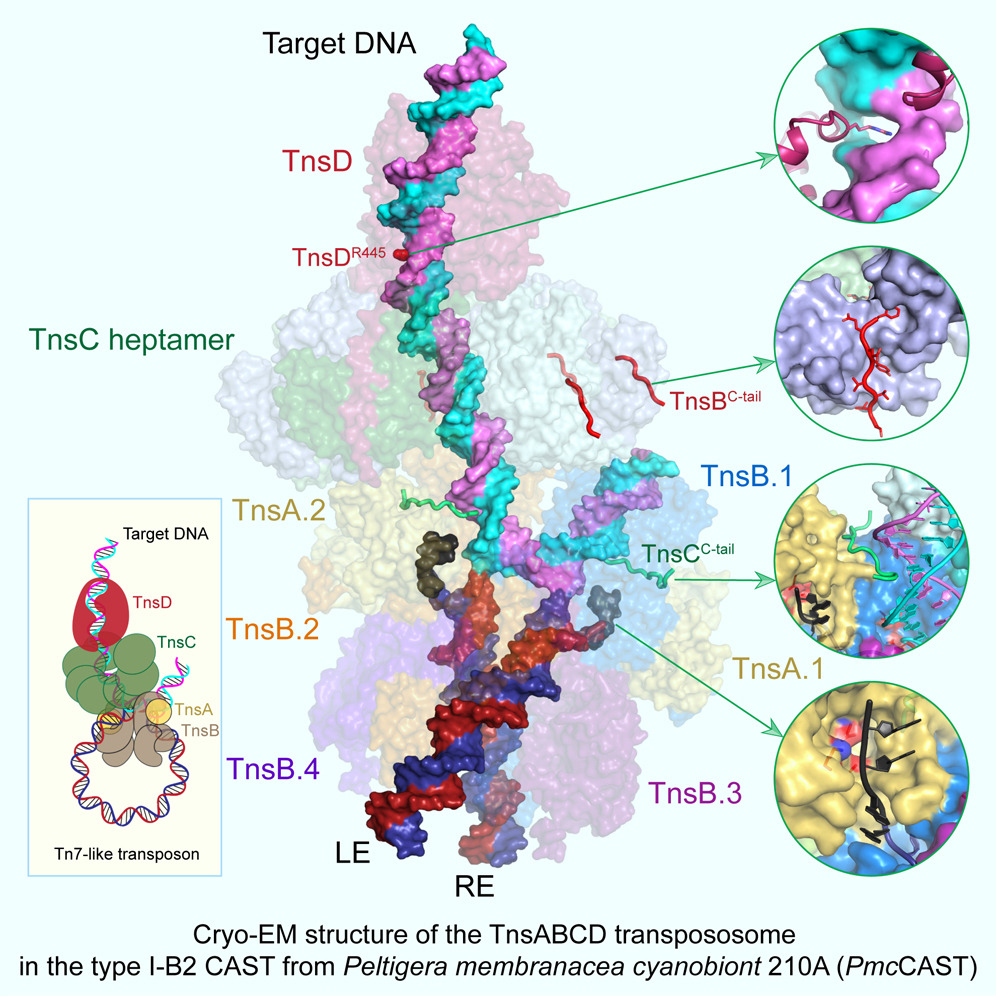
Tn7类转座子以其能够特异性插入宿主染色体而著称。TnsD识别附着位点(att位点)后,会招募TnsABC蛋白形成转座体,促进转座过程。尽管这一途径已经得到充分研究,但对该过程的原子级结构洞察仍然相对缺乏。
来自美国普渡大学Leifu Chang课题组展示了在苔藓衣藻共生体210A中的Tn7类转座子(一种I-B型CRISPR相关转座子)的TnsC-TnsD-att DNA复合物及TnsABCD转座体的冷冻电镜(cryo-EM)结构。结构揭示了att DNA的显著弯曲,特征为TnsD的精氨酸侧链插入CC/GG二核苷酸步骤中。TnsABCD转座体结构揭示了TnsA和TnsB的相互作用,并表明TnsC不仅招募TnsAB,还直接参与了转座体的组装。这些发现为Tn7类转座子的靶向DNA插入机制提供了见解,并对提高其基因组编辑应用的精确性和效率具有重要意义。
2024/10/08
2. “A potent pan-sarbecovirus neutralizing antibody resilient to epitope diversification”
一种对抗广谱sarbecovirus的强效中和抗体,能够抵御表位多样化
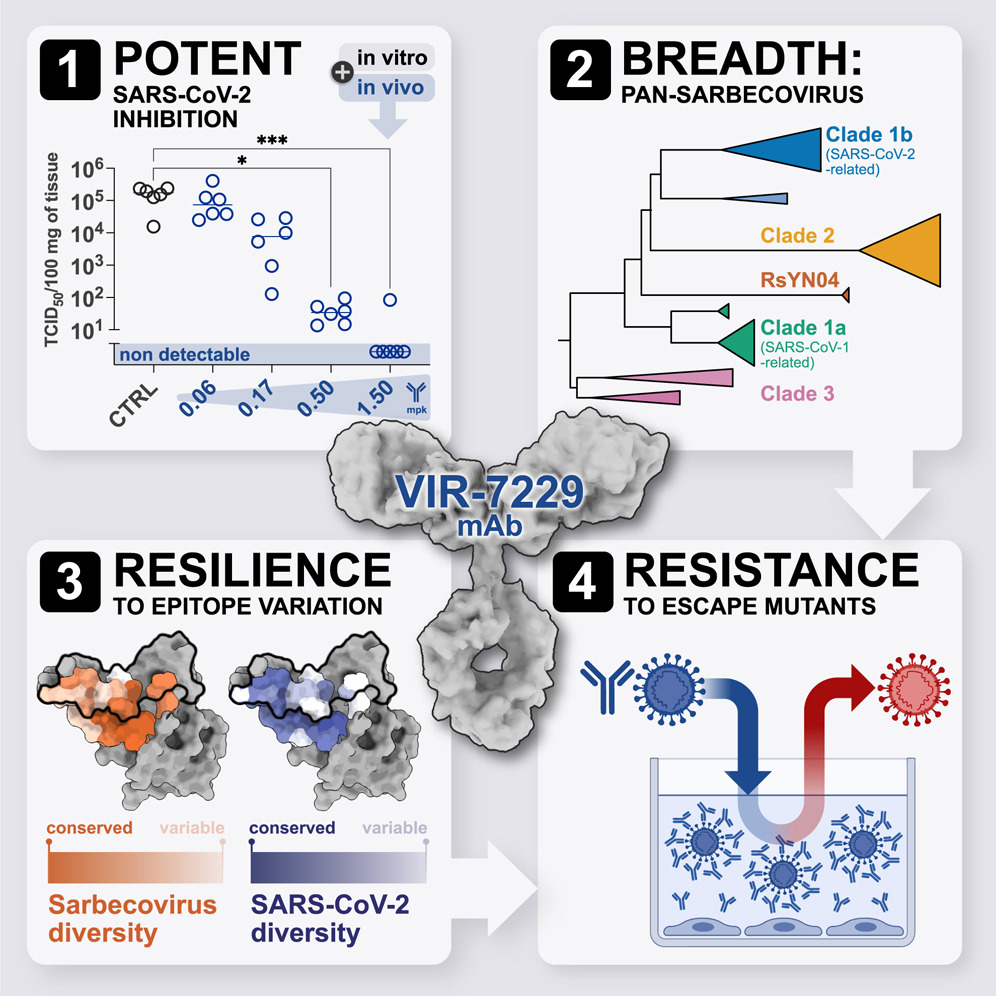
严重急性呼吸综合征冠状病毒2(SARS-CoV-2)的进化导致病毒逃逸临床授权的单克隆抗体(mAbs),因此迫切需要对表位多样化具有韧性的单克隆抗体。尽管病毒不断演化,能够进入临床开发并保持活性的广谱中和冠状病毒抗体仍然稀缺。
来自美国犹他大学的Tyler N. Starr,华盛顿大学的David Veesler以及瑞士Humabs生物医学公司的Davide Corti团队合作鉴定出一种人源单克隆抗体,命名为VIR-7229,针对病毒受体结合基序(RBM),具有前所未有的广泛交叉反应性,可中和所有sarbecovirus类群,包括不利用ACE2的蝙蝠sarbecovirus,并强效中和自2019年以来的SARS-CoV-2变种,包括近期的EG.5、BA.2.86和JN.1。VIR-7229对表位多样性具有高度耐受性,这部分归因于其高结合亲和力、受体分子模拟及其与RBM骨架原子的相互作用。因此,VIR-7229具有高逃逸突变屏障,逃逸突变极为罕见且与病毒适应性降低有关,显示出其对未来病毒进化的韧性潜力。VIR-7229是一种有望成为下一代药物的有力候选者。
2024/10/11
3. “Structural basis of respiratory complex adaptation to cold temperatures”
呼吸复合物适应低温的结构基础
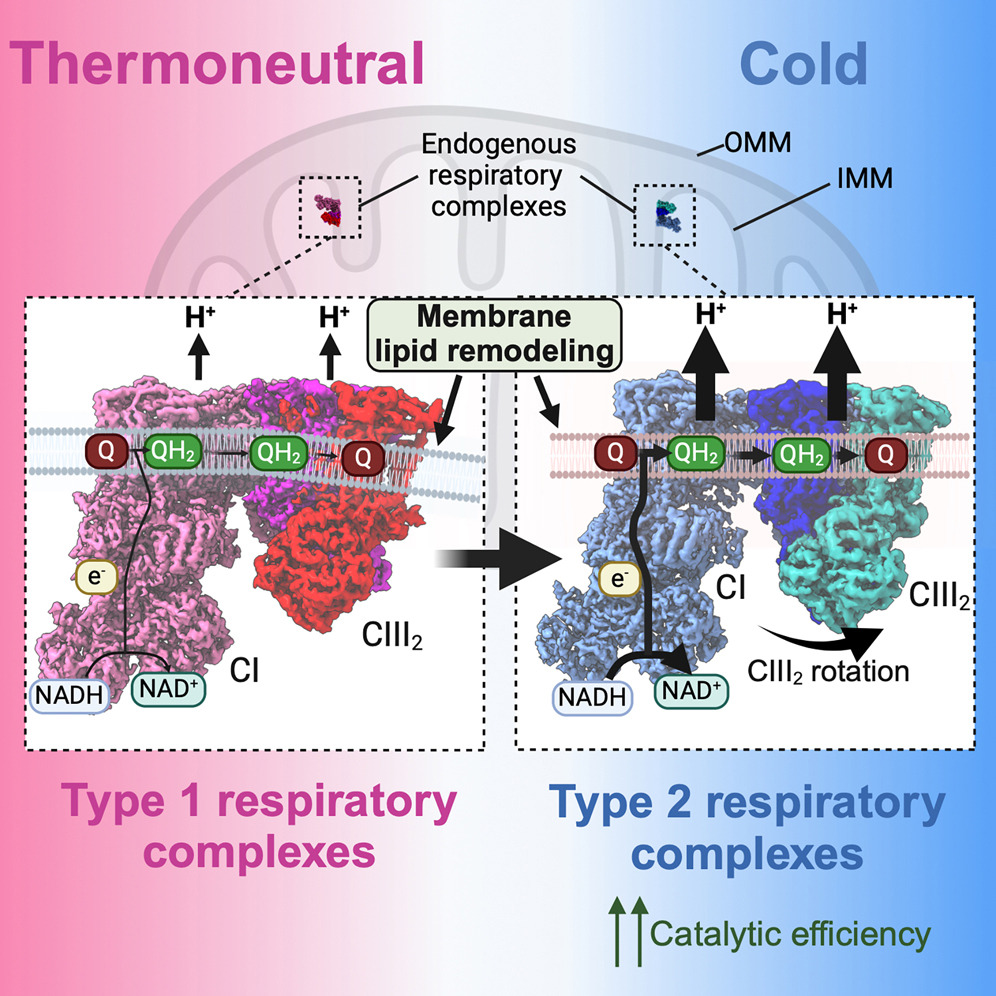
在应对寒冷时,哺乳动物会激活棕色脂肪,通过依赖于电子传递链的呼吸性产热来维持体温。然而,呼吸复合物在寒冷暴露下适应的结构基础仍然不清楚。
来自南方科技大学的廖茂富与Dana-Farber癌症研究所Pere Puigserver团队合作结合了体温调节生理学和冷冻电镜(cryo-EM)技术,研究了暴露于不同温度的小鼠内源性呼吸超复合物。研究者识别出一种由寒冷诱导的CI:III2(称为2型)超复合物构象,其中CIII2围绕其二聚体间轴旋转约25°,缩短了复合物间的Q交换空间,并呈现出有利于电子转移的催化状态。线粒体膜中的大规模超复合物模拟揭示了脂质-蛋白质排列如何稳定2型复合物,以增强催化活性。结合研究者的cryo-EM研究、多尺度模拟和生化分析,揭示了棕色脂肪在结构和能量层面上提高呼吸能力的体温调节机制与动态变化。
2024/10/11
4.“Genome integrity sensing by the broad-spectrum Hachiman antiphage defense complex”
广谱Hachiman抗噬菌体防御复合物对基因组完整性的感知

Hachiman是一种广谱抗噬菌体防御系统,其功能此前未知。
来自美国加州大学伯克利分校的Jennifer A. Doudna团队研究表明,Hachiman是一个异源二聚体核酸酶-解旋酶复合物,称为HamAB。HamA是一种此前未知功能的蛋白质,是效应核酸酶,而HamB是感应解旋酶。在完整的双链DNA(dsDNA)监测过程中,HamB限制了HamA的活性。当HamAB复合物检测到DNA损伤时,HamB的解旋酶活性激活HamA,从而释放出核酸酶活性。Hachiman的激活会降解细胞内的所有DNA,形成既无噬菌体也无宿主DNA的“幽灵”细胞。研究者通过使用DNA损伤剂在无噬菌体的情况下成功激活Hachiman,这表明Hachiman对异常DNA状态作出响应。Hachiman解旋酶与真核生物和古细菌酶之间的系统发生学相似性暗示了其与其他生命域中的重要解旋酶在功能上的深层共性。
01
Cell Research
本周无
02
Molecular Cell
本周无
03
Nature Structural & Molecular Biology
10.08
1.“Structural basis for Vipp1 membrane binding: from loose coats and carpets to ring and rod assemblies”
Vipp1膜结合的结构基础:从松散的包覆和地毯状结构到环状和杆状组装
10.08
2.“Cryo-EM structure of the human subcortical maternal complex and the associated discovery of infertility-associated variants”
人类皮层下母性复合物的冷冻电镜结构及与不孕相关变异的发现
10.11
3.“Structural basis of antimicrobial membrane coat assembly by human GBP1”
人类GBP1抗菌膜包覆组装的结构基础
04
Nature Communications
10.07
1) “Structural basis for receptor-binding domain mobility of the spike in SARS-CoV-2 BA.2.86 and JN.1”
SARS-CoV-2 BA.2.86和JN.1中刺突蛋白受体结合域的结构基础
10.07
2)“Structure of the Nipah virus polymerase phosphoprotein complex”
尼帕病毒聚合酶磷蛋白复合物的结构
10.08
3 )“Structure of a Rhs effector clade domain provides mechanistic insights into type VI secretion system toxin delivery”
Rhs效应子结构域的结构提供了VI型分泌系统毒素传递的机制性见解
10.08
4)“The discovery and structural basis of two distinct state-dependent inhibitors of BamA”
两种不同状态依赖性BamA抑制剂的发现及其结构基础
10.08
5)“Structural and functional insights into the T-even type bacteriophage topoisomerase II”
T-even型噬菌体拓扑异构酶II的结构与功能洞察
10.08
6)“Ribosomes hibernate on mitochondria during cellular stress”
核糖体在细胞应激下在线粒体上进入休眠状态
10.09
7)“Mycobacterial HelD connects RNA polymerase recycling with transcription initiation”
分枝杆菌HelD连接RNA聚合酶回收与转录起始
10.09
8)“Structural basis of μ-opioid receptor targeting by a nanobody antagonist”
μ-阿片受体靶向纳米抗体拮抗剂的结构基础
10.09
9.“Structural basis for antibiotic transport and inhibition in PepT2”
PepT2中抗生素转运和抑制的结构基础
10.09
10.“Unmasking AlphaFold to integrate experiments and predictions in multimeric complexes”
揭开AlphaFold的面纱,将实验与多聚体复合物预测结合
10.10
11. “Molecular mechanism for regulating APOBEC3G DNA editing function by the non-catalytic domain”
APOBEC3G DNA编辑功能的非催化域调控的分子机制
10.10
12.“Foot-and-mouth disease virus antigenic landscape and reduced immunogenicity elucidated in atomic detail”
口蹄疫病毒抗原结构及其降低免疫原性的原子细节
10.11
13. “Structural basis for synthase activation and cellulose modification in the E. coli Type II Bcs secretion system”
大肠杆菌II型Bcs分泌系统中合酶激活与纤维素修饰的结构基础
10.11
14.“Advanced glycation end-product crosslinking activates a type VI secretion system phospholipase effector protein”
高级糖基化终产物交联激活VI型分泌系统磷脂酶效应蛋白
10.11
15. “Direct recognition of an intact foreign protein by an αβ T cell receptor”
αβ T细胞受体对完整外源蛋白的直接识别
10.12
16.“Principles of paralog-specific targeted protein degradation engaging the C-degron E3 KLHDC2”
靶向C-degron E3 KLHDC2的旁系特异性蛋白质降解原理
05
Science Advances
10.09
1.“SLC26A4-AP-2 mu2 interaction regulates SLC26A4 plasma membrane abundance in the endolymphatic sac”
SLC26A4-AP-2 mu2相互作用调节内淋巴囊中SLC26A4的质膜丰度
10.09
2.“Filament structures unveil the dynamic organization of human acetyl-CoA carboxylase”
纤维结构揭示了人类乙酰辅酶A羧化酶的动态组织
10.11
3.“Mechanism of degrader-targeted protein ubiquitinability”
降解剂靶向蛋白质泛素化的机制
10.11
4.“Structures of the Foamy virus fusion protein reveal an unexpected link with the F protein of paramyxo- and pneumoviruses”
Foamy病毒融合蛋白的结构揭示了其与副黏病毒和肺炎病毒F蛋白的意外关联
10.09
5.“Architectures of photosynthetic RC-LH1 supercomplexes from Rhodobacter blasticus”
红细菌光合RC-LH1超复合物的结构









